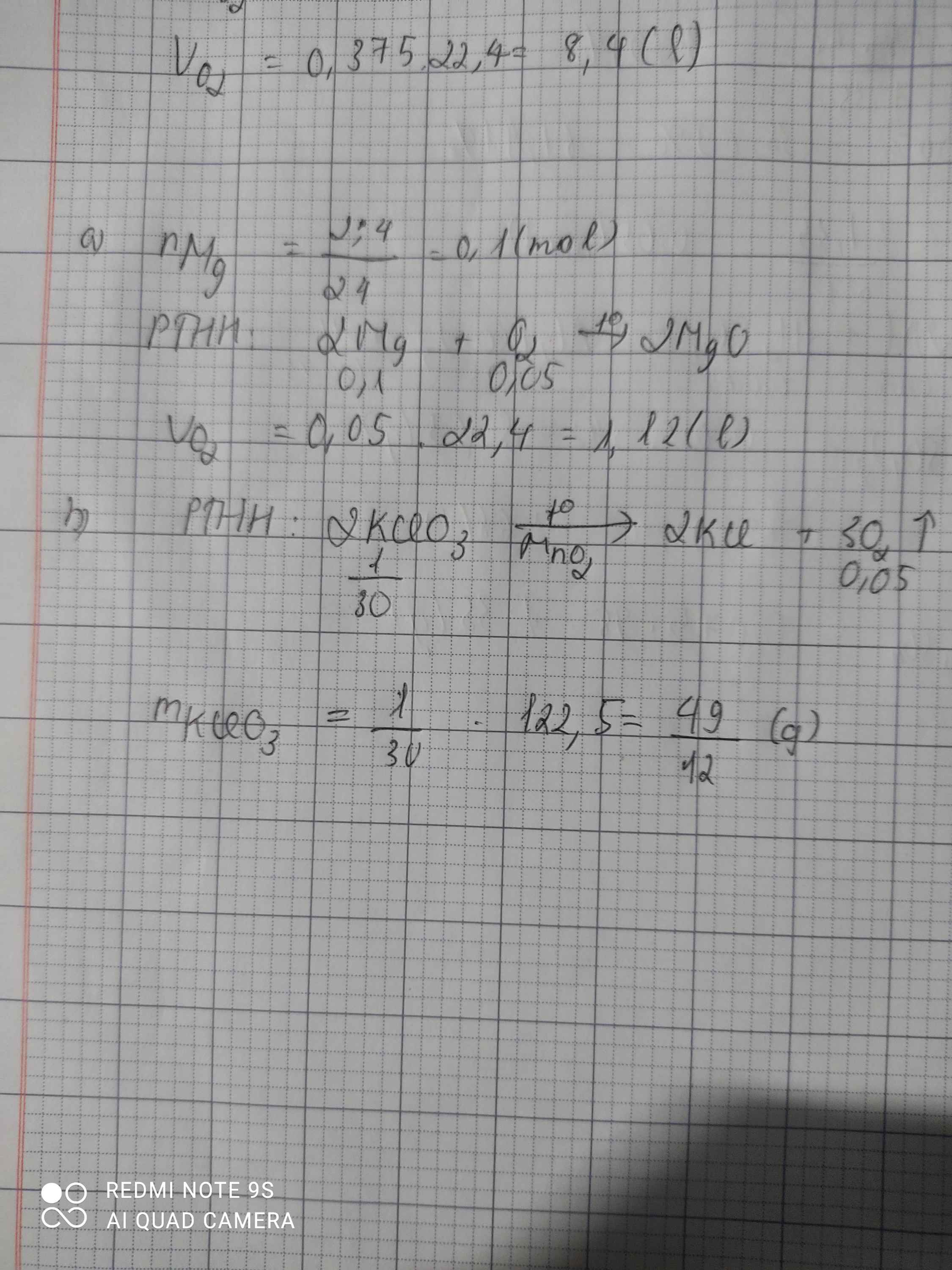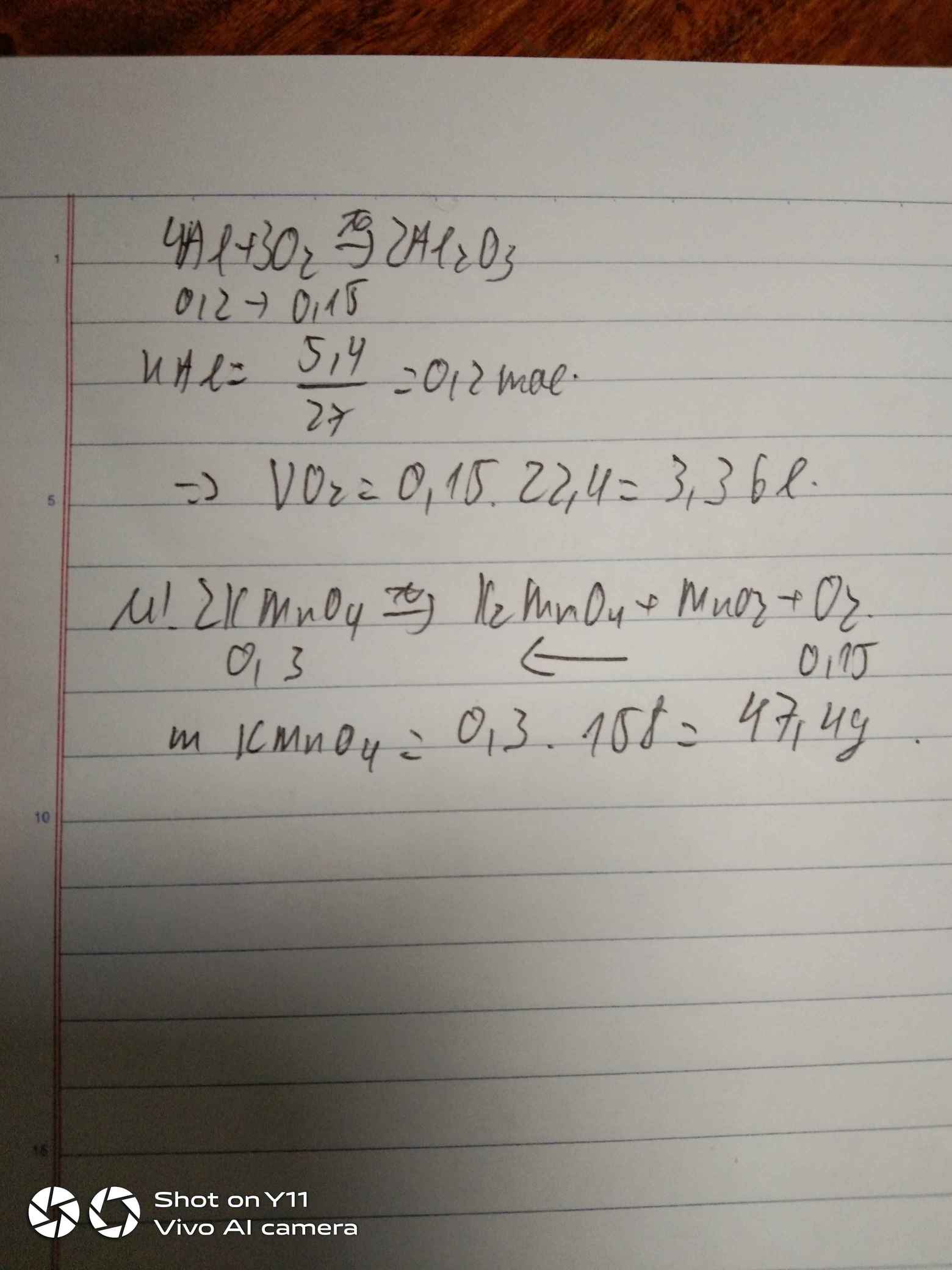Đốt cháy hoàn toàn 7,2g cacbon.
a,Tính thể tích oxi cần dùng(đktc).
b,Tính khối lượng KClO3 cần dùng để điều chế lượng oxi trên?Tính thể tích không khí cần dùng??

Những câu hỏi liên quan
Đốt cháy hoàn toàn 16,8 lít khí hidro.
a)Tính thể tích khí oxi và thể tích không khí cần dùng cho phản ứng trên (biết các thể tích đo ở đktc và oxi chiếm 20% thể tích không khí)
b)tính khối lượng KMnO4(hoặc KClO3)cần dùng để điều chế đc lượng oxi trên
Theo gt ta có: $n_{H_2}=0,75(mol)$
a, $2H_2+O_2\rightarrow 2H_2O$
Ta có: $n_{O_2}=0,5.n_{H_2}=0,375(mol)\Rightarrow V_{O_2}=8,4(l)\Rightarrow V_{kk}=42(l)$
b, $2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2$
Ta có: $n_{KMnO_4}=2.n_{O_2}=0,75(mol)\Rightarrow m_{KMnO_4}=118,5(g)$
Đúng 1
Bình luận (0)
a)
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ V_{O_2} = \dfrac{V_{H_2}}{2} = \dfrac{16,8}{2} = 8,4(lít)\\ V_{không\ khí} = \dfrac{8,4}{20\%} = 42(lít)\)
b)
\(n_{O_2} = \dfrac{8,4}{22,4} = 0,375(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,75(mol)\\ \Rightarrow m_{KMnO_4} = 0,75.158 = 118,5(gam)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,25(mol)\\ \Rightarrow m_{KClO_3} = 0,25.122,5 = 30,625(gam)\)
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{16.8}{22.4}=0.75\left(mol\right)\)
\(2H_2+O_2\underrightarrow{t^0}2H_2O\)
\(0.75...0.375\)
\(V_{O_2}=0.375\cdot22.4=8.4\left(l\right)\)
\(V_{kk}=5V_{O_2}=8.4\cdot5=42\left(l\right)\)
\(2KMnO_4\underrightarrow{t^0}K_2MnO_4+MnO_2+O_2\)
\(0.75..............................................0.375\)
\(m_{KMnO_4}=0.75\cdot158=118.5\left(g\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.25.......................0.375\)
\(m_{KClO_3}=0.25\cdot122.5=30.625\left(g\right)\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Đốt cháy hoàn toàn 5,4 g kim loại nhôm Al trong khí oxi. a. Tính thể tích khí oxi (đktc) cần dùng cho phản ứng. b. Tính khối lượng KClO3 cần dùng để điều chế lượng oxi trên.
a) $n_{Al} = \dfrac{5,4}{27} = 0,2(mol)$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
Theo PTHH : $n_{O_2} = \dfrac{3}{4}n_{Al} = 0,15(mol)$
$V_{O_2} = 0,15.22,4 = 3,36(lít)$
b) $2 KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
$n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,1(mol)$
$m_{KClO_3} = 0,1.122,5 = 12,25(gam)$
Đúng 1
Bình luận (0)
\(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ PTHH:4Al+3O_2-^{t^o}>2Al_2O_3\)
tỉ lệ: 4 : 3 : 2
n(mol) 0,2---->0,15---->0,1
\(V_{O_2\left(dktc\right)}=n\cdot22,4=0,15\cdot22,4=3,36\left(l\right)\\ PTHH:2KClO_3-^{t^o}>2KCl+3O_2\)
tỉ lệ: 2 : 2 : 3
n(mol) 0,1<-------------------------0,15
\(m_{KClO_3}=n\cdot M=0,1\cdot\left(39+35,5+16\cdot3\right)=12,25\left(g\right)\)
Đúng 1
Bình luận (0)
4Al+3O2-to>2Al2O3
0,2---0,15------0,1 mol
n Al=0,2 mol
VO2=0,15.22,4=3,36l
b) 2KClO3-to>2KCl +3O2
0,1---------------------0,15 mol
->m KClO3=0,1.122,5g
#yT
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 2,4g magie (Mg) trong khí oxi thu được magie oxit (MgO)
a) Tính thể tích khí oxi cần dùng (thể tích khí đo ở đktc)
b) Tính số gam KClO3 cần dùng để điều chế lượng oxi trên
\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,6 gam magie trong khí oxi trên thì khối lượng kali clorat cần dùng.
A. Tính thể tích khí oxi (đktc) cần dùng?
B. Nếu dùng dịch KCLO3(có xúc tác MnO2) để điều chế lượng khí oxi trên thì khối lượng kali clorat cần dùng là bao nhiêu?
(O=16,CL=35,5,K=39,Mn=55)
2Mg+O2-to>2MgO
0,15---0,075 mol
2KClO3-to->2KCl+3O2
0,05-----------------------0,075
n Mg=\(\dfrac{3,6}{24}\)=0,15 mol
=>VO2=0,075.22,4=1,68l
=>m KClO3=0,05.122,5=6,125g
Đúng 3
Bình luận (0)
a. \(n_{Mg}=\dfrac{3.6}{24}=0,15\left(mol\right)\)
PTHH : 2Mg + O2 ----to----> 2MgO
0,15 0,075
\(V_{O_2}=0,075.22,4=1,68\left(l\right)\)
b. PTHH : 2KClO3 \(\xrightarrow[MnO_2]{t^o}\) 2KCl + 3O2
0,05 0,075
\(m_{KClO_3}=0,05.122,5=6,125\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 6. Đốt cháy hoàn toàn 6,2g photpho trong không khí.a.Tính thể tích không khí cần dùng ở đktc. Biết thể tích Oxi chiếm 1/5 thể tích không khí. b. Tính khối lượng kali pemanganat cần dùng để điều chế lượng oxi nói trên.
Đọc tiếp
Câu 6. Đốt cháy hoàn toàn 6,2g photpho trong không khí.
a.Tính thể tích không khí cần dùng ở đktc. Biết thể tích Oxi chiếm 1/5 thể tích không khí.
b. Tính khối lượng kali pemanganat cần dùng để điều chế lượng oxi nói trên.
a) \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,2-->0,25
=> VO2 = 0,25.22,4 = 5,6 (l)
=> Vkk = 5,6.5 = 28 (l)
b)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,5<-----------------------------0,25
=> \(m_{KMnO_4}=0,5.158=79\left(g\right)\)
Đúng 4
Bình luận (0)
Câu: biết rằng Oxi chiếm 20% thể tích không khí. Đốt cháy hoàn toàn 6,4 gam Cu bằng khí oxi
a) tính thể tích không khí cần dùng (đktc)
b) tính số gam KClO3 cần dùng để điều chế lượng oxi trên ( Cho Cu=64, K=39, Cl=35,5. O=16)
a.\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,1 0,05 ( mol )
\(V_{kk}=\left(0,05.22,4\right).5=5,6l\)
b.\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
1/30 0,05 ( mol )
\(m_{KClO_3}=\dfrac{1}{30}.122,5=4,08g\)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 14,4 g cacbon trong bình đựng khí oxi .
a)Tính thể tích khí oxi cần dùng ( đktc) ?
b)Nếu đốt hoàn toàn lượng cacbon trên trong không khí thì thể tích không khí ( đktc) cần dùng
là bao nhiêu ?
c)Tính khối lượng KClO 3 bị nung nóng để thu được lượng oxi cần cho phản ứng trên, biết
trong quá trình thu khí có hao hụt 20% ?
\(n_C=\dfrac{14,4}{44}=\dfrac{18}{55}\left(mol\right)\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{O_2}=n_C=n_{CO_2}=\dfrac{18}{55}\left(mol\right)\\ a,V_{O_2\left(đktc\right)}=\dfrac{18}{55}.22,4=\dfrac{2016}{275}\left(lít\right)\\ b,V_{kk}=\dfrac{100}{21}.\dfrac{2016}{275}=\dfrac{381}{11}\left(lít\right)\\ c,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3\left(LT\right)}=\dfrac{2}{3}.n_{O_2}=\dfrac{2}{3}.\dfrac{18}{55}=\dfrac{12}{55}\left(mol\right)\\ \Rightarrow n_{KClO_3\left(TT\right)}=120\%.\dfrac{12}{55}=\dfrac{72}{275}\left(mol\right)\\ \Rightarrow m_{KClO_3}=122,5.\dfrac{72}{275}=\dfrac{1764}{55}\left(g\right)\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn m gam nhôm trong oxi dư người ta thu được 30,6 gam nhôm oxit (Al2O3)a) Tìm khối lượng nhôm phản ứng, thể tích oxi, thể tích không khí cần dùng b)Tính khối lượng Kaliclorat (KClO3 )cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H100%) c)Tính khối lượng Kaliclorat cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H75%) (K39, Cl35,5, Al27, O16)
Đọc tiếp
Đốt cháy hoàn toàn m gam nhôm trong oxi dư người ta thu được 30,6 gam nhôm oxit (Al2O3)
a) Tìm khối lượng nhôm phản ứng, thể tích oxi, thể tích không khí cần dùng
b)Tính khối lượng Kaliclorat (KClO3 )cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H=100%)
c)Tính khối lượng Kaliclorat cần dùng để điều chế được lượng oxi dùng cho phản ứng trên? (Hiệu suất phản ứng nung là H=75%) (K=39, Cl=35,5, Al=27, O=16)
a.\(n_{Al_2O_3}=\dfrac{30,6}{102}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,6 0,45 0,3 ( mol )
\(m_{Al}=0,6.27=16,2g\)
\(V_{O_2}=0,45.22,4=10,08l\)
\(V_{kk}=10,08.5=50,4l\)
b.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(m_{KClO_3}=0,3.122,5=36,75g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(n_{KClO_3}=\dfrac{0,3}{75\%}=0,4mol\)
\(m_{KClO_3}=0,4.122,5=49g\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 13gam Zn trong bình chứa khí oxi
a, viết PTHH của phản ứng
b, tính thêt tích khí oxi, thể tích không khí cần dùng ở đktc(biết oxi chiếm 1/5 thể tích không khí)
Tính khối lượng KMnO4 cần dùng để điều chế đủ lượng oxi cho phản ứng trên
a, \(2Zn+O_2\underrightarrow{t^o}2ZnO\)
b, \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Zn}=0,1\left(mol\right)\Rightarrow V_{O_2}=0,1.22,4=2,24\left(l\right)\)
\(\Rightarrow V_{kk}=5V_{O_2}=11,2\left(l\right)\)
c, \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,2\left(mol\right)\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Đúng 3
Bình luận (0)
Đốt cháy hoàn toàn 5,4 gam nhôm. A. Tính thể tích khí oxi cần dùng (đktc) B. Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.
nAl = 5,4/27 = 0,2 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,2 ---> 0,15
VO2 = 0,15 . 22,4 = 3,36 (l)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,15 . 2 = 0,3 (mol)
mKMnO4 = 0,3 . 158 = 47,4 (g)
Đúng 3
Bình luận (1)