Cho kim loại : Zn,Alo,Fe,Mg lần lượt tác dụng với dung dịch H2SO4 loãng. Nếu cho cùng một khối lượng kim loại trên tác dụng hết với axit ,thì kim loại nào cho nhiều khí h2 nhất

Những câu hỏi liên quan
Lấy cùng một khối lượng ban đầu các kim loại Mg,Al,Zn,Fe cho tác dụng với dung dịch H2SO4 loãng dư. Kim loại nào giải phóng lượng khí H2 nhiều nhất ở cùng điều kiện ?
A. Mg
B. Zn
C. Fe
D. Al
Đáp án : D
Khi phản ứng với H+
1 mol Al -> 1,5 mol H2
1 mol (Zn,Mg,Fe) -> 1 mol H2
Đúng 0
Bình luận (0)
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng. b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất? c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 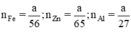
Theo pt nH2 (1) = nZn = 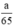 mol
mol
nH2 (2) = nFe = 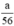 mol
mol
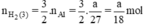
Như vậy ta nhận thấy 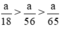 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
cho các kim loại Mg,Al,Zn lần lượt tác dụng với dung dịch axit HCl.Nếu thu được cùng lượng khí H2 thì khối lượng kim loại nào cần ít nhất
Gọi x là số mol \(H_2\) thu được
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
x <----------------------------- x
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\dfrac{2}{3}x\) <---------------------------- x
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
x <----------------------------- x
có:
\(m_{Mg}=24x\) (g)
\(m_{Al}=27.\dfrac{2}{3}x=18x\) (g)
\(m_{Zn}=65x\left(g\right)\)
Vì 18x < 24x< 65x
=> Al là kim loại cần số gam ít nhất.
☕T.Lam
Đúng 3
Bình luận (0)
Cho các kim loại : kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.a, Viết các phương trình phản ứngb, Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hidro nhất ?c, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ? giúp mình nhé các bạn ?
Đọc tiếp
Cho các kim loại : kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a, Viết các phương trình phản ứng
b, Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hidro nhất ?
c, Nếu thu được cùng một thể tích khí hidro thì khối lượng kim loại nào dùng cho phản ứng là nhỏ nhất ?
giúp mình nhé các bạn ?
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit thì kim loại nào cho nhiều khí hiđro nhất ?
c) Nếu thu được cùng một thể tích khí Hiđro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất ?
a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)
Đúng 1
Bình luận (0)
Bài 1: Cho các kim loại Zn,Al,Để lần lượt tác dụng với dung dịch axit HCl
a, Viết các PTHH của phản ứng
b, Cho cùng 1 khối lượng các kim loại trên tác dụng với axit dư thì kim loại nào cho nhiều khí H² nhất?
c, Nếu thu được cùng 1 thể tích khí H² thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 2: Cho 11,2g Fe tác dụng với dung dịch loãng có chứa 9,8g axit H²SO⁴
a, Chất nào còn dư sau phản ứng và dư bao nhiêu g?
b, Tính thể tích khí H² thu được ở đktc
- Xác định nguyên tố kim loại
Đọc tiếp
Bài 1: Cho các kim loại Zn,Al,Để lần lượt tác dụng với dung dịch axit HCl
a, Viết các PTHH của phản ứng
b, Cho cùng 1 khối lượng các kim loại trên tác dụng với axit dư thì kim loại nào cho nhiều khí H² nhất?
c, Nếu thu được cùng 1 thể tích khí H² thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
Bài 2: Cho 11,2g Fe tác dụng với dung dịch loãng có chứa 9,8g axit H²SO⁴
a, Chất nào còn dư sau phản ứng và dư bao nhiêu g?
b, Tính thể tích khí H² thu được ở đktc
- Xác định nguyên tố kim loại
Bài 1:
a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
b, Giả sử: mZn = mAl = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=n_{Al}=\dfrac{a}{27}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
Vậy: Al cho nhiều khí H2 hơn.
c, Giả sử: nH2 (1) = nH2 (2) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=n_{H_2\left(2\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=27b\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{Zn}>m_{Al}\)
Vậy: Khối lượng Al đã pư nhỏ hơn.
Bài 2:
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a, Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\), ta được Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0,1\left(mol\right)\Rightarrow m_{Fe\left(dư\right)}=0,1.56=5,6\left(g\right)\)
b, Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (2)
Cho kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a. Viết các phương trình hóa học của các phản ứng.
b. Cho cùng một khối lượng các kim loại trên tác dụng hết với axit dư thì kim loại nào cho nhiều khí hidro nhất?
c. Nếu thu được cùng một thể tích khí hidro thì khối lượng của kim loại nào đã phản ứng là nhỏ nhất?
a)
$Zn + H_2SO_4 \to ZnSO_4 + H_2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2(2)$
$Fe + H_2SO_4 \to FeSO_4 + H_2(3)$
b)
Coi m Zn = m Al = m Fe = 100(gam)
\(n_{H_2(1)} = n_{Zn} = \dfrac{100}{65}(mol)\\ n_{H_2(2)} = \dfrac{3}{2}n_{Al} = \dfrac{3}{2}.\dfrac{100}{27} = \dfrac{100}{18}(mol)\\ n_{H_2(3)} = n_{Fe} = \dfrac{100}{56}(mol)\\\)
Ta thấy :
\(n_{H_2(1)} < n_{H_2(3)} < n_{H_2(2)}\) nên dùng kim loại Al cho được nhiều khí hidro nhất.
c) Coi $n_{H_2} = 1(mol)$
n Zn = n H2 = 1(mol) => m Zn = 1.65 = 65(gam)
n Al = 3/2 n H2 = 1,5(mol) => m Al = 1,5.27 = 40,5(gam)
n Fe = n H2 = 1(mol) => m Fe = 1.56 = 56(gam)
Vậy cùng một thể tích hidro thì Al có khối lượng nhỏ nhất
Đúng 2
Bình luận (0)
a, PT: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\) (2)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (3)
b, Giả sử: mZn = mAl = mFe = a (g)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{Al}=\dfrac{a}{27}\left(mol\right)\\n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2\left(1\right)}=n_{Zn}=\dfrac{a}{65}\left(mol\right)\\n_{H_2\left(2\right)}=\dfrac{3}{2}n_{Al}=\dfrac{a}{18}\left(mol\right)\\n_{H_2\left(3\right)}=n_{Fe}=\dfrac{a}{56}\left(mol\right)\end{matrix}\right.\)
⇒ Al cho nhiều khí H2 nhất.
c, Giả sử: nH2 (1) = nH2 (2) = nH2 (3) = b (mol)
Theo PT: \(\left\{{}\begin{matrix}n_{Zn}=n_{H_2\left(1\right)}=b\left(mol\right)\\n_{Al}=\dfrac{2}{3}n_{H_2\left(2\right)}=\dfrac{2}{3}b\left(mol\right)\\n_{Fe}=n_{H_2\left(3\right)}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=65b\left(g\right)\\m_{Al}=\dfrac{2}{3}b.27=18b\left(g\right)\\m_{Fe}=56b\left(g\right)\end{matrix}\right.\)
⇒ Khối lượng Al pư là nhỏ nhất.
Đúng 1
Bình luận (0)
Tham Khảo :
a) PTHH:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2} \\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2} \\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4}\right)_{3}+3 \mathrm{H}_{2} \end{array}\)
b) Giả sử một khối lượng là \(\text{a (g)}\) kim loại kẽm sắt và nhôm cho cùng:
\(\begin{array}{l} \mathrm{Zn}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{ZnSO}_{4}+\mathrm{H}_{2}\\ \mathrm{Fe}+\mathrm{H}_{2} \mathrm{SO}_{4 \text { loãng }} \rightarrow \mathrm{FeSO}_{4}+\mathrm{H}_{2}\\ 2 \mathrm{Al}+3 \mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Al}_{2}\left(\mathrm{SO}_{4)_{3}}+3 \mathrm{H}_{2}\right.\\ \text { Ta có } \mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} ; \mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} ; \mathrm{n}_{\mathrm{Al}}=\frac{\mathrm{a}}{27}\\ \text { Theo } \mathrm{pt} \mathrm{n}_{\mathrm{H}_{2}}(1)=\mathrm{n}_{\mathrm{Zn}}=\frac{\mathrm{a}}{65} \mathrm{~mol}\\ \mathrm{n}_{\mathrm{H}_{2}(2)}=\mathrm{n}_{\mathrm{Fe}}=\frac{\mathrm{a}}{56} \mathrm{~mol} \end{array}\)\(\begin{array}{l} \mathrm{n}_{\mathrm{H}_{2}(3)}=\frac{3}{2} \cdot \mathrm{n}_{\mathrm{A} 1}=\frac{3}{2} \cdot \frac{\mathrm{a}}{27}=\frac{\mathrm{a}}{18} \mathrm{~mol}\\ \text { Như vậy ta nhận thấy } \frac{a}{18}>\frac{a}{56}>\frac{a}{65} \Rightarrow \mathrm{n}_{H_{2}}(3)>\mathrm{n}_{\mathrm{H}_{2}}(2)>\mathrm{n}_{\mathrm{H}_{2}}(1) \end{array}\)
Vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)
Kim loại nào cho nhiều thể tích khí H 2 hơn khi cho cùng một khối lượng hai kim loại Zn và Fe tác dụng hết với axit H 2 S O 4 ?
A. không xác định được
B. Zn
C. bằng nhau
D. Fe
Chọn D
Z n + H 2 S O 4 → Z n S O 4 + H 2
F e + H 2 S O 4 → F e S O 4 + H 2
Do hai kim loại có cùng khối lượng nên kim loại nào có nguyên tử khối bé hơn sẽ cho nhiều khí H 2 hơn.
Đúng 0
Bình luận (0)
Nếu lấy cùng một khối lượng kim loại Na, Al, Fe rồi cho tác dụng lần lượt với dung dịch HCl dư thì kim loại nào cho nhiều thể tích khí H2 (đktc) nhất
2Na + 2HCl => 2NaCl + H2
x/23________________x/46
2Al + 6HCl => 2AlCl3 + 3H2
x/27_________________x/18
Fe + 2HCl => FeCl2 + H2
x/56_______________x/56
x/18 > x/46 > x/56
=> Al cho nhiều H2 nhất
Đúng 2
Bình luận (0)
Gọi KL là x. (g) (x>0)
PTHH: Na + HCl -> NaCl + 1/2 H2
x/23___________________x/46(mol)
PTHH: 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
x/27_______________________x/18(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
x/56_____________________x/56(mol)
Vì số mol tỉ lệ thuận thể tích : x/18 > x/46> x/56
=>Kim loại Al cho thể tích H2 lớn nhất.
Đúng 2
Bình luận (1)






















