Cho 13g Zn tác dụng hết với dd HCl 2M. Tính CM muối thu được

Những câu hỏi liên quan
cho 43,5gam MnO2 tác dụng hết với 250gam dd HCl thu được khí A. dẫn khí A qua 400ml dd NaOH 5M thu được dd B
a) tính nồng độ mol các muối trong dd B
b) Tính C% của dd HCl ban đầu (dùng dư 10% so với phản ứng)
MnO2+4HCl->MnCl2+H2O+Cl2
0,5---------2------0,5--------0,5---0,5
Cl2+2NaOH->NaClO+NaCl+H2O
0,5-----1--------0,5----------0,5------0,5
n MnO2 =\(\dfrac{43.5}{87}\)=0,5 mol
n NaOH=5.0,4=2 mol
=>NaOH dư :0,1 mol
=>CM NaCl= CM NaClO =\(\dfrac{1}{0,4}\)=2,5M
=>CM NaOH dư =1\(\dfrac{1}{0,4}\)=2,5M
b)
C%HCl =\(\dfrac{2.36,5}{250}100\)=29,2%
dùng dư 10%
=>C%HCl=29,2+10=39,2%
Đúng 0
Bình luận (2)
cho 200ml dd X gồm NAOH 1M và KOH 2m tác dụng vừa đủ với V ml dd Y gồm H2SO4 1M và HCl 1M thu được dd Z chứa m gam muối khan. tính m và V
cho 17,7 gam hỗn hợp kẽm và sắt tác dụng hết với dd H2SO4 loãng, dư thu được 6,72 lít khí H2 ở dktc . tính thành phần % số moll mỗi kim loại trong hỗn hơp ban đầu? khối lượng muối thu được
a)
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4 → FeSO4 + H2
b) Gọi số mol Zn và Fe có trong 17,7 gam hỗn hợp là x và y mol. nH2 = \(\dfrac{6,72}{22,4}\)=0,3 mol
Theo tỉ lệ phản ứng ta có\(\left\{{}\begin{matrix}x+y=0,3\\65x+56y=17,7\end{matrix}\right.\)=> x = 0,1 và y = 0,2
=>%n Zn=\(\dfrac{0,1}{0,3}100=33,33\%\)
=>%n Fe=66,67%
=>m muối= 0,1.161+0,2.152=46,5g
Đúng 4
Bình luận (0)
Gọi số mol Fe, Zn là a, b (mol)
=> 56a + 65b = 17,7 (1)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
a----------------->a--->a
Zn + H2SO4 --> ZnSO4 + H2
b------------------->b----->b
=> a + b = 0,3 (2)
(1)(2) => a = 0,2 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%n_{Fe}=\dfrac{0,2}{0,3}.100\%=66,67\%\\\%n_{Zn}=\dfrac{0,1}{0,3}.100\%=33,33\%\end{matrix}\right.\)
mmuối = 0,2.152 + 0,1.161 = 46,5 (g)
Đúng 2
Bình luận (0)
Cho m gam Zinc (Zn) tác dụng vừa đủ với V lít dung dịch hydrochloric acid (HCl) thu được 6,72 lít khí hydrogen (H2) ở đktca) Viết phương trình phản ứng xảy rab) Tính giá trị m và khối lượng muối thu được sau phản ứngc) Tính giá Vd) Dẫn toàn bộ lượng khí hydrogen thu được ở trên đi qua 32 gam bột Fe2O3 đun nóng. Tính khối lượng chất rắn thu được sau phản ứng
Đọc tiếp
Cho m gam Zinc (Zn) tác dụng vừa đủ với V lít dung dịch hydrochloric acid (HCl) thu được 6,72 lít khí hydrogen (H2) ở đktc
a) Viết phương trình phản ứng xảy ra
b) Tính giá trị m và khối lượng muối thu được sau phản ứng
c) Tính giá V
d) Dẫn toàn bộ lượng khí hydrogen thu được ở trên đi qua 32 gam bột Fe2O3 đun nóng. Tính khối lượng chất rắn thu được sau phản ứng
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Zn + 2HCl ---> FeCl2 + H2
0,3<---------------0,3<----0,3
=> \(\left\{{}\begin{matrix}m=0,3.65=19,5\left(g\right)\\m_{muối}=0,3.136=40,8\left(g\right)\\V_{ddHCl}:thiếu.C_M\end{matrix}\right.\)
\(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
LTL: \(0,2>\dfrac{0,3}{3}\) => Fe2O3 dư
Theo pthh: nFe2O3 (pư) = \(\dfrac{1}{3}n_{H_2}=\dfrac{1}{3}.0,3=0,1\left(mol\right)\)
nFe = \(\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\)
=> mchất rắn = 0,1.160 + 0,2.56 = 27,2 (g)
Đúng 2
Bình luận (1)
Zn+2HCl->ZnCl2+H2
0,3---0,6----0,3----0,3
n H2=0,3 mol
=>m Zn=0,3.65=19,5g
=>m muối=0,3.136=40,8g
c) thiếu đề
d)
Fe2O3+3H2-to>2Fe+3H2O
0,3------0,2
n Fe2O3=0,2 mol
=>Fe2O3 dư
=>m cr=0,2.56+0,1.160=27,2g
Đúng 2
Bình luận (0)
cho x gam sắt tác dụng hết với dung dịch axit clohiđric HCL thu được sắt tác dụng clorua và 2,24l khí hiđro ở đktc. tính giá trị của x
nH2 = 2.24/22.4 = 0.1 (mol)
Fe + 2HCl => FeCl2 + H2
0.1...............................0.1
mFe = 0.1 * 56 = 5.6 (g)
Đúng 2
Bình luận (0)
nH = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Fe + 2HCl \(\rightarrow\)FeCl2 + H2
(mol) 0,1\(\leftarrow\)--------------------0,1
mFe = 0,1 . 56 = 5,6 (g)
Vậy x = 5,6
Đúng 1
Bình luận (0)
nH2 = 2.24/22.4 = 0.1 (mol)
Fe + 2HCl => FeCl2 + H2
0.1...............................0.1
mFe = 0.1 * 56 = 5.6 (g)
Đúng 0
Bình luận (0)
Cho 23,8g hỗn hợp X gồm Cu,Fe,Al tác dụng vừa đủ với 14,56l Cl2 ở đktc thu được muối Y,mặt khác cứ 0,25 mol X tác dụng với dung dịch HCl dư thu được 0,2 mol khí H2. Tính % khối lượng các kim loại trong hỗn hợp X
một loại nước tự nhiên chứa Ca2+, HOC3-, Na+,Cl-Để loại bỏ hết ion Ca2+ trong m(gam) loại nước này người ta phải cho vào V ml dd Ca(OH)2 0.04M. Tính V biết: -Đun sôi m(gam) nước này 1 hồi lâu thì được 5g kết tủa-Nếu cho 2m (gam) nước này cùng tác dụng với HCL vừa đủ thu được 11.2(l) khí và dd A. Cho dd A tác dụng với dd AgNO3 dư thu được 140.63 (gam) kết tủa
Đọc tiếp
một loại nước tự nhiên chứa Ca2+, HOC3-, Na+,Cl-
Để loại bỏ hết ion Ca2+ trong m(gam) loại nước này người ta phải cho vào V ml dd Ca(OH)2 0.04M. Tính V biết:
-Đun sôi m(gam) nước này 1 hồi lâu thì được 5g kết tủa
-Nếu cho 2m (gam) nước này cùng tác dụng với HCL vừa đủ thu được 11.2(l) khí và dd A. Cho dd A tác dụng với dd AgNO3 dư thu được 140.63 (gam) kết tủa
Cho 1,6 gam CuO tác dụng hết với HCl dư. Cô cạn dd sau pứ thu được bao nhiêu gam muối khan.

Số mol
Phương trình
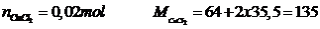
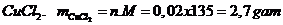
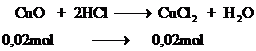
 khối lượng
khối lượng
Vậy khối lượng muối  khan là 2,7 gam
khan là 2,7 gam
Đúng 0
Bình luận (0)
Hoà tan 30 g X ( Fe,Mg,Al,Zn) bằng dd HCl dư thu được 2,24 lít H2 (đkc) . Mặc khác cho X tác dụng với H2SO4 đặc nóng thu được 3,36 lít SO2 . Tính % Fe về khối lượng ?
Goi x, y, z, t la` so' mol tuong ung'
pu' voi' HCl: Fe chi bi oxh len Fe(2+)
Fe - 2e; Mg - 2e; Al - 3e; Zn - 2e => ne = 2x + 2y + 3z + 2t
2H(+) + 2e ---> H2 => ne = 2nH2 = 0.2
btoan` e --> 2x + 2y + 3z + 2t = 0.2 (1)
pu' voi' H2SO4dn': Fe bi oxh len Fe(3+)
Fe - 3e; Mg - 2e; Al - 3e; Zn - 2e
S(+6) + 2e ---> SO2
btoan` e --> 3x + 2y + 3z + 2t = 2nSO2 = 0.3 (2)
(2) - (1) = x = 0.1 --> %mFe = 0.1*\(\dfrac{56}{30}\) = 18.67%
Đúng 0
Bình luận (0)
Hoà tan 30 g X ( Fe,Mg,Al,Zn) bằng dd HCl dư thu được 2,24 lít H2 (đkc) . Mặc khác cho X tác dụng với H2SO4 đặc nóng thu được 3,36 lít SO2 . Tính % Fe về khối lượng ?
Goi x, y, z, t la` so' mol tuong ung'
pu' voi' HCl: Fe chi bi oxh len Fe(2+)
Fe - 2e; Mg - 2e; Al - 3e; Zn - 2e => ne = 2x + 2y + 3z + 2t
2H(+) + 2e ---> H2 => ne = 2nH2 = 0.2
btoan` e --> 2x + 2y + 3z + 2t = 0.2 (1)
pu' voi' H2SO4dn': Fe bi oxh len Fe(3+)
Fe - 3e; Mg - 2e; Al - 3e; Zn - 2e
S(+6) + 2e ---> SO2
btoan` e --> 3x + 2y + 3z + 2t = 2nSO2 = 0.3 (2)
(2) - (1) = x = 0.1 --> %mFe = 0.1*56/30 = 18.67%
Đúng 0
Bình luận (0)

























