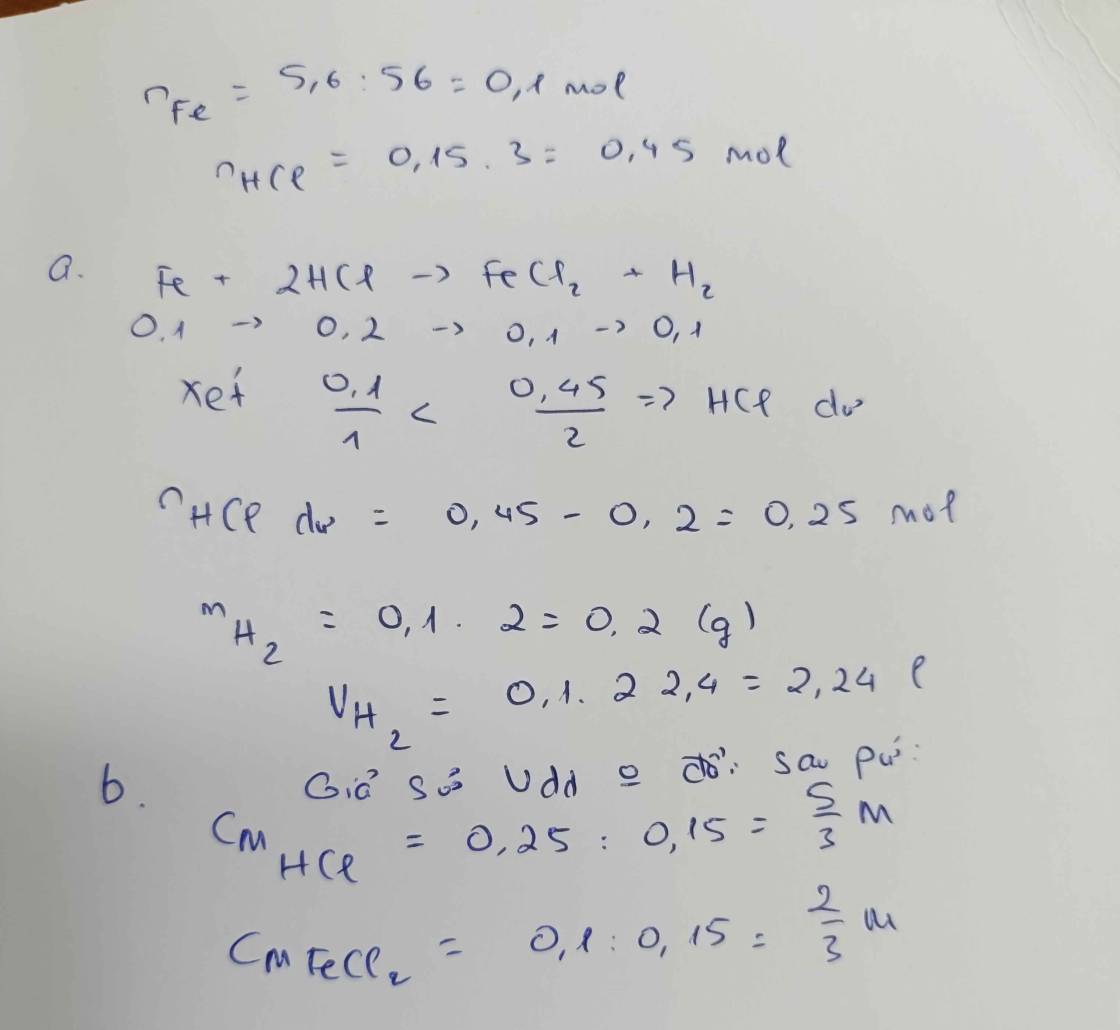cho 22 4g sắt tác dụng với dung dịch hcl 4m tính nộng độ mol dung dịch sau phản ứng

Những câu hỏi liên quan
Câu 3. Cho 4g MgO tác dụng hoàn toàn với 100ml dung dịch HCl nồng độ 4M.
a. Sau phản ứng chất nào dư? Dư bao nhiêu gam?
b. Tính nồng độ mol (CM) các dung dịch thu được sau phản ứng.
Ta có: \(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(n_{HCl}=4.100:1000=0,4\left(mol\right)\)
a. PTHH: MgO + 2HCl ---> MgCl2 + H2O
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\)
Vậy HCl dư.
=> \(n_{dư}=\dfrac{0,1.2}{0,4}=0,5\left(mol\right)\)
=> \(m_{dư}=0,5.36,5=18,2\left(g\right)\)
b. Ta có: \(V_{dd_{MgCl_2}}=V_{HCl}=\dfrac{100}{1000}=0,1\left(lít\right)\)
Theo PT: \(n_{MgCl_2}=n_{MgO}=0,1\left(mol\right)\)
=> \(C_{M_{MgCl_2}}=\dfrac{0,1}{0,1}=1M\)
Đúng 1
Bình luận (1)
Cho 5,6 gam kim loại Fe tác dụng với 150 ml dung dịch HCl. Sau phản ứng thu được muối sắt (II) clorua (FeCl2) và khí H2. a. Tính nồng độ mol dung dịch HCl đã phản ứng và thể tích khí H2 (ở đktc) sau phản ứng? b. Cần dùng bao nhiêu lít dung dịch NaOH 2M để phản ứng hết với muối sắt (II) clorua (FeCl2) thu được ở trên
Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
____0,1______0,2_____0,1____0,1 (mol)
a, \(C_{M_{HCl}}=\dfrac{0,2}{0,15}=\dfrac{4}{3}\left(M\right)\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\)
Theo PT: \(n_{NaOH}=2n_{FeCl_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{NaOH}=\dfrac{0,2}{2}=0,1\left(l\right)\)
Đúng 5
Bình luận (0)
Cho 5,6g sắt tác dụng với 150ml dung dịch HCl 3M a, Tính m-H2 & V-H2 ở điều kiện tiêu chuẩn b, Tính nồng độ mol các chất có trong dung dịch sau phản ứng
cho 5,6 gam sắt tác dụng với axit clohiđric. tính khối lượng axit hcl tham gia phản ứng. vẫn dùng lượng sắt như trên tác dụng với 400ml dung dịch hcl nồng độ im chất nào còng dư sau phản ứng , lượng dư là bao nhiêu mol
Đề cho lượng 1 chất sao lại hỏi dư hay k
Đúng 0
Bình luận (0)
cho 250g dung dịch HCl 7,3% tác dụng với 4g CuO
a) Viết pthh
b)tính khối lượng muối tạo thành
c)c Tính nồng độ % các chất trong dung dịch sau phản ứng
nHCl= (7,3%.250)/100=0,5(mol)
nCuO=0,05(mol)
a) PTHH: CuO +2 HCl -> CuCl2 + H2O
Ta có: 0,5/2 > 0,05/1
=> HCl dư, CuO hết => tính theo nCuO
b) nCuCl2=nCuO=0,05(mol) => mCuCl2= 135. 0,05= 6,75(g)
c) nHCl(dư)=0,5-0,05.2=0,4(mol) => mHCl(dư)=0,4.36,5=14,6(g)
mddsau=250+4= 254(g)
=>C%ddCuCl2= (6,75/254).100=2,657%
C%ddHCl(dư)= (14,6/254).100=5,748%
Đúng 2
Bình luận (1)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{7,3.250}{100}=18,25\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{4}{80}=0,05\left(mol\right)\)
a) Pt : 2HCl + CuO → CuCl2 + H2O\(|\)
2 1 1 1
0,5 0,05 0,05
b) Lập tỉ số so sánh : \(\dfrac{0,5}{2}>\dfrac{0,05}{1}\)
⇒ HCl dư , CuO phản ứng hết
⇒ Tính toán dựa vào số mol của CuO
Số mol của muối đồng (II) clorua
nCuCl2 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối đồng (II) clorua
mCuCl2 = nCuCl2 . MCuCl2
= 0,05 . 135
= 6,75 (g)
c) Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,5 -(0,05 . 2)
= 0,4 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư= ndư . MHCl
= 0,4. 36,5
= 14,6 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mHCl + mCuO
= 250 + 4
= 254 (g)
Nồng độ phần trăm của muối đồng (II) clorua
C0/0CuCl2 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{6,75.100}{254}=2,66\)0/0
Nồng độ phần trăm của dung dịch axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{14,6.100}{254}=5,75\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Câu: 5: Cho a gam sắt tác dụng với 50 ml dung dịch HCl . Sau phản ứng thu được 3,36 lít khí hidro (đktc).
a. Viết phương trình
b. Tính khối lượng sắt phẳn ứng và khối lượng muối sinh ra ?
c. Tính nồng độ mol dung dịch axit ?
a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 015 0,3 0,15 0,15
b, \(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{FeCl_2}=0,15.127=19,05\left(g\right)\)
c, \(C_{M_{ddHCl}}=\dfrac{0,3}{0,05}=6M\)
Đúng 2
Bình luận (0)
Cho 1,02 g Al2O3 tác dụng với 100ml dung dịch HCl 1m. Tính tính nồng độ mol dung dịch sau phản ứng
$n_{Al_2O_3} = \dfrac{1,02}{102} = 0,01(mol) ; n_{HCl} = 0,1(mol)$
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,01.........0,06.........0,02..........................(mol)
Suy ra :
$C_{M_{AlCl_3}} = \dfrac{0,02}{0,1} = 0,2M$
$C_{M_{HCl\ dư}} = \dfrac{0,1 - 0,06}{0,1} = 0,4M$
Đúng 1
Bình luận (0)
cho 16g CuO tác dụng với 200ml dung dịch HCl
a) Tính nồng độ mol của dung dịch sau phản ứng
b) Tính khối lượng HCl phản ứng
\(n_{CuO}=\dfrac{16}{80}=0,2mol\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
0,2 0,4 0,2 0,2
\(C_{M_{HCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,4}{0,2}=2M\)
\(m_{HCl}=0,4\cdot36,5=14,6g\)
Đúng 1
Bình luận (1)
nCuO = 16/80 = 0,2 (mol)
PTHH: CuO + 2HCl -> CuCl2 + H2
Mol: 0,2 ---> 0,4 ---> 0,2 ---> 0,2
CMCuCl2 = 0,2/0,2 = 1M
mHCl = 0,4 . 36,5 = 14,6 (g)
Đúng 1
Bình luận (0)
cho 11,2 gam sắt tác dụng vừa đủ với 200 gam dung dịch HCL. a) tính nồng độ phần trăm của dung dịch HCL. b) tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng?
a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{HCl} =2 n_{Fe} = 0,2.2 = 0,4(mol)$
$C\%_{HCl} = \dfrac{0,4.36,5}{200}.100\% = 7,3\%$
b) $n_{H_2} = n_{FeCl_2} = n_{Fe} = 0,2(mol)
Sau phản ứng, $m_{dd} = 11,2 + 200 - 0,2.2 = 210,8(gam)$
$C\%_{FeCl_2} = \dfrac{0,2.127}{210,8}.100\% = 12,05\%$
Đúng 2
Bình luận (0)