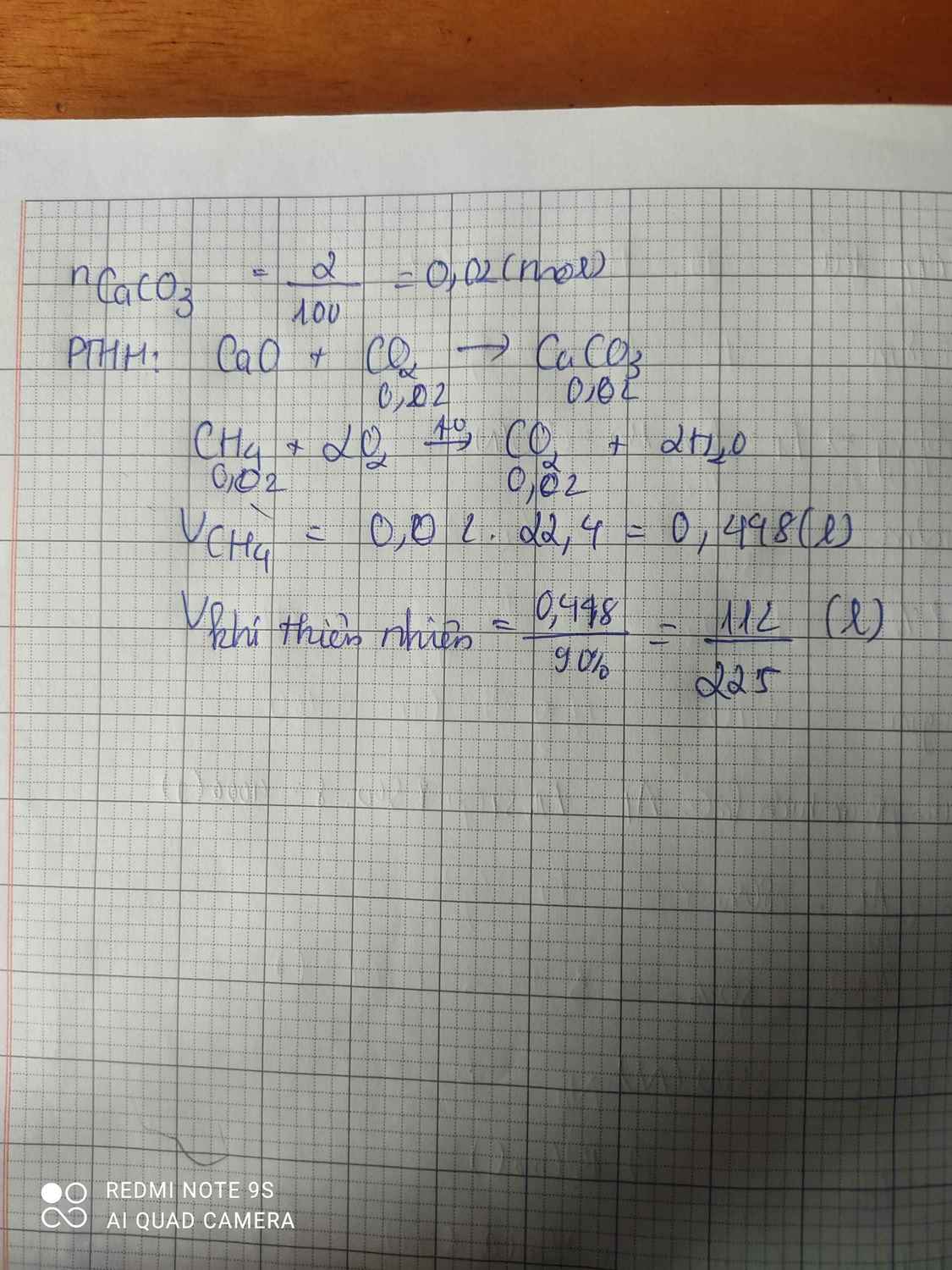Đốt cháy 8l khí Mêtan ( CH4) trong 6l O2 . Tính V CO2

Những câu hỏi liên quan
Khí mêtan CH4 có trong tự nhiên hoặc trong khí bioga, khí mêtan cháy trong không khí sinh ra khí (CO2) và nước (H2O). Hãy:
a. Viết phương trình phản ứng xảy ra
b. Tính thể tích khí CO2 (đktc) thu được sau khi đốt cháy hoàn toàn 3,36lít khí mêtan ( đktc).
Xem chi tiết
a) PTHH: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
b) Vì trong chất khí, tỉ lệ về số mol cũng chính là tỉ lệ về thể tích
\(\Rightarrow V_{CH_4}=V_{CO_2}=3,36\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy 8l khí Mêtan ( CH4) trong 6l O2 . Tính V CO2
CH4 + 2O2 -> CO2 + 2H2O
nCH4=\(\dfrac{8}{22,4}=\dfrac{5}{14}\left(mol\right)\)
nO2=\(\dfrac{6}{22,4}=\dfrac{15}{56}\left(mol\right)\)
Vì \(2.\dfrac{5}{14}>\dfrac{15}{56}\) nên CH4 dư
theo PTHH ta có:
\(\dfrac{1}{2}\)nO2=nCO2=\(\dfrac{15}{112}\left(mol\right)\)
VCO2=\(\dfrac{15}{112}.22,4=3\left(lít\right)\)
Đúng 0
Bình luận (0)
tính thể tích không khí < oxi chiếm 20%> cần và thể tích Co2 sinh ra khi đốt cháy 10 lít khí mêtan Ch4
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ thể tích cũng là tỉ lệ số mol.
Theo PT: \(\left\{{}\begin{matrix}V_{CO_2}=V_{CH_4}=10\left(l\right)\\V_{O_2}=2V_{CH_4}=20\left(l\right)\end{matrix}\right.\)
\(\Rightarrow V_{kk}=\dfrac{20}{20\%}=100\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy V lít CH4 bằng lượng oxi dư ở đktc.
a) Tính V biết rằng dẫn toàn bộ sản phẩm cháy qua bình đựng nước vôi trong dư thì thu được 2g kết tủa.
b) Tính thể tích khí thiên nhiên chứa khí mêtan trên biết rằng mêtan chiếm 90% khí thiên nhiên trên.
a)\(n_{CaCO_3}=\dfrac{2}{100}=0,02mol\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
0,02 0,02
\(CH_4+2O_2\rightarrow CO_2+2H_2O\)
0,02 0,02
\(V_{CH_4}=0,02\cdot22,4=0,448l\)
b) \(V_{CH_4}=90\%V_{tựnhiên}\)
\(\Rightarrow V_{tựnhiên}=\dfrac{V_{CH_4}}{90\%}=\dfrac{0,448}{90\%}\approx0,5l\)
Đúng 1
Bình luận (1)
Đốt cháy 3,2g CH4= khí O2 thu được CO2 và H2O.
a)Tính V CO2 cần dùng ở đktc
b)Tính khối lượng H2O
\(n_{CH_4}=\dfrac{3,2}{16}=0,2\left(mol\right)\)
a. PTHH: CH4 + 2O2 ---to---> CO2 + 2H2O
Theo PT: \(n_{CO_2}=n_{CH_4}=0,2\left(mol\right)\)
=> \(V_{CO_2}=0,2.22,4=4,48\left(lít\right)\)
b. Theo PT: \(n_{H_2O}=2.n_{CH_4}=2.0,2=0,4\left(mol\right)\)
=> \(m_{H_2O}=0,4.18=7,2\left(g\right)\)
Đúng 0
Bình luận (0)
PTHH: \(CH_4+2O_2\xrightarrow[]{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{3,2}{16}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,4\left(mol\right)=n_{H_2O}\\n_{CO_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,4\cdot22,4=8,96\left(l\right)\\V_{CO_2}=0,2\cdot22,4=4,48\left(l\right)\\m_{H_2O}=0,4\cdot18=7,2\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho sơ đồ phản ứng: CH4+O2->CO2+H2O Đốt cháy hoàn toàn 1,12l CH4. Tính thể tích khí O2 cần dùng và tính thể tích khí CO2 tạo thành(đktc)
Xem chi tiết
\(n_{CH_4}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(0.05.....0.1.......0.05\)
\(V_{O_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(V_{CO_2}=0.05\cdot22.4=1.12\left(l\right)\)
Đúng 4
Bình luận (0)
Đốt cháy khí metan theo sơ đồ phản ứng : CH4 + O2 ---> CO2 + H2O
Tính thể tích khí O2 ; CO2 ; hơi H2O khi đốt chyá hết 20 lít CH4.
Các thể tích đo cùng điều kiện nhiệt độ và áp suất.
Đốt cháy 50ml hh CH4 và C2H2 cần 110ml khí O2. Tính: a/ %(V) mỗi khí trong hh b/ Thể tích CO2 sinh ra các khí đo ở cùng điều kiện t° và P (áp suất)
Giả sử các khí đo ở điều kiện sao cho 1 mol khí chiếm thể tích V lít
Gọi số mol CH4, C2H2 là a, b (mol)
=> \(a+b=\dfrac{0,05}{V}\) (1)
\(n_{O_2}=\dfrac{0,11}{V}\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a-->2a---------->a
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
b--->2,5b-------->2b
=> \(2a+2,5b=\dfrac{0,11}{V}\) (2)
(1)(2) => \(\left\{{}\begin{matrix}a=\dfrac{0,03}{V}\left(mol\right)\\b=\dfrac{0,02}{V}\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{\dfrac{0,03}{V}.V}{0,05}.100\%=60\%\\\%V_{C_2H_2}=\dfrac{\dfrac{0,02}{V}.V}{0,05}.100\%=40\%\end{matrix}\right.\)
b) \(n_{CO_2}=a+2b=\dfrac{0,07}{V}\left(mol\right)\)
=> \(V_{CO_2}=\dfrac{0,07}{V}.V=0,07\left(l\right)\)
Đúng 5
Bình luận (0)
Tham khảo:
a)
{VC2H2=x(ml)
VC2H4=y(ml)
⇒ x + y = 50(1)
C2H2+5/2O2(to)→2CO2+H2O
C2H4+3O2(to)→2CO2+2H2O
Theo PTHH : 2,5x + 3y = 140(2)
Từ (1)(2) suy ra: x = 20 ; y = 30
Vậy :
%VC2H2=2050.100%=40%%
VC2H4=100%−40%=60%
b)VCO2=2VC2H2+2VC2H4=2.50=100(ml)
Đúng 3
Bình luận (0)
a)
{VC2H2=x(ml)
VC2H4=y(ml)
⇒ x + y = 50(1)
C2H2+5/2O2(to)→2CO2+H2O
C2H4+3O2(to)→2CO2+2H2O
Theo PTHH : 2,5x + 3y = 140(2)
Từ (1)(2) suy ra: x = 20 ; y = 30
Vậy :
%VC2H2=2050.100%=40%%
VC2H4=100%−40%=60%
b)VCO2=2VC2H2+2VC2H4=2.50=100(ml)
Đúng 0
Bình luận (0)
Bài 7: Đốt cháy hoàn toàn 3,36 lít (đktc) khí metan CH4 ) trong không khí theo phản ứng: CH4 + O2 --- CO2 + H2Oa. Tính thể tích oxi (đktc) đã tham gia phản ứng.b. Tính thể tích không khí cần thiết để đốt cháy. Biết trong không khí oxi chiếm 20% thể tích.
Đọc tiếp
Bài 7: Đốt cháy hoàn toàn 3,36 lít (đktc) khí metan CH4 ) trong không khí theo phản ứng:
![]()
CH4 + O2 --- > CO2 + H2O
a. Tính thể tích oxi (đktc) đã tham gia phản ứng.
b. Tính thể tích không khí cần thiết để đốt cháy. Biết trong không khí oxi chiếm 20% thể tích.
nCH4 = 3,36 : 22,4 = 0,15 (mol)
pthh : CH4 + 2O2 -t--> CO2 + 2H2O
0,15 0,3
=> VO2 = 0,3 . 22,4 = 6,72 (L)
ta có : VO2 = 20% Vkk => Vkk = VO2 : 20% = 6,72 : 20% = 33,6 (L)
Đúng 2
Bình luận (0)
\(n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\\ Mol:0,15\rightarrow0,3\\ \rightarrow\left\{{}\begin{matrix}V_{O_2}=0,3.22,4=6,72\left(l\right)\\V_{kk}=6,72.5=33,6\left(l\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)