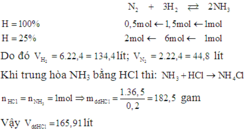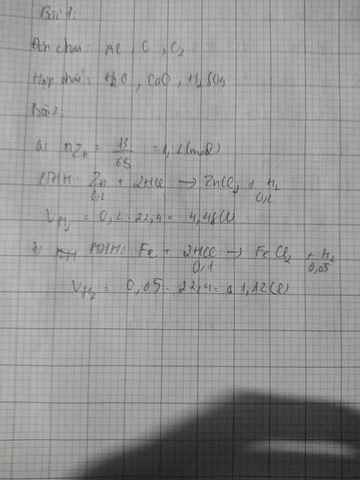tính thể tích dung dịch HCL 17,52% (d=1,1g/ml) để điều chế đc 4,48l khí cl ( đktc) biết H=8o%

Những câu hỏi liên quan
cho 1,3 g zn vào 200 ml dung dịch HCl 0,3 M có khối lượng riêng 1,1g/ml
a thính thể tích khí (đktc) thu đc sau phản ứng
b tính nồng đọ % các chất trong dung dịch sau phản ứng
nZn=1,3/65=0,02(mol) doi 200ml=0,2l
nHCl=0,2.0,3=0,06(mol)
pt: Zn + 2HCl---> ZnCl2 + h2
bd 0,02 0,06
pu 0,02->0,04 0,02 0,02
spu 0 0,02 0,02 0,02
VddH2=0,02.22,4=0,048(l)
Đúng 0
Bình luận (0)
Cho 2,4(g) kim loại Mg phản ứng với 250 ml dung dịch axit HCl 1M.
a,tính thể tích khí H2 thu đc(đktc)
b,tính nồng độ mol các chất trong dung dịch sau phản ứng
(cho:Mg=24,H=1,Cl=35,5)
a. nMg =\(\dfrac{2,4}{24}\) = 0,1 mol , nHCl = 1.0,25 = 0,25 mol
Ta có pt phản ứng : Mg + 2HCl → MgCl2 + H2
Theo phương trình : 1 2 1 1 ( mol)
Tức cứ 1 mol Mg sẽ phản ứng vừa đủ với 2 mol HCl , nên 0,1 mol Mg sẽ phản ứng hết với 0,2 mol HCl mà
Theo đề bài : 0,1 0.25 (mol)
Vậy Mg phản ứng hết và HCl dư = 0,25-0,2 = 0,05 ( mol)
nH2 = nMg = 0,1 mol .
==> V H2(đktc) = n .22,4 = 0,1 . 22,4 = 2,24 lít
b. Các chất trong dung dịch sau phản ứng gồm :\(\left\{{}\begin{matrix}HCldư=0,05mol\\MgCl2=0,1mol\end{matrix}\right.\)
Thể tích của dung dịch là 250ml = 0,25 lít
CM HCl = \(\dfrac{n}{v}\)= \(\dfrac{0,05}{0,25}\)= 0,2 ( mol/l)
CM MgCl2 = \(\dfrac{n}{v}\)=\(\dfrac{0,1}{0,25}\)= 0,4 ( mol/l)
Đúng 2
Bình luận (0)
Phải dùng bao nhiêu lít N2 và H2 (đktc) để điều chế 17 gam NH3. Biết hiệu suất chuyển hoán thành NH3 là 25%. Nếu dùng dung dịch HCl 20% (d 1,1g/ml) để trung hòa lượng NH3 trên thì cần bao nhiêu ml? A. 165,91 lít B. 163 lít C. 175,91 lít D. 153 lít
Đọc tiếp
Phải dùng bao nhiêu lít N2 và H2 (đktc) để điều chế 17 gam NH3. Biết hiệu suất chuyển hoán thành NH3 là 25%. Nếu dùng dung dịch HCl 20% (d = 1,1g/ml) để trung hòa lượng NH3 trên thì cần bao nhiêu ml?
A. 165,91 lít
B. 163 lít
C. 175,91 lít
D. 153 lít
Hòa tan hết 33g hỗn hợp Mg, MgCO3 trong 800ml dung dịch HCl 2M (d=1,1g/ml) thu được 11,2l hỗn hợp khí A(đktc)
1.Tính % thể tích các chất khí trong A
2.Tính C% các chất trong dung dịch sau phản ứng
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\)
a, \(n_A=0,5\left(mol\right)=n_{H_2}+n_{CO_2}\)
\(m_{hh}=33=24n_{Mg}+84n_{MgCO_3}=84n_{CO_2}+24n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,15\left(30\%\right)\\n_{CO_2}=0,35\left(70\%\right)\end{matrix}\right.\) ( mol )
b, Có \(n_{HCl}=2n_{H_2}+2n_{CO_2}=1\left(mol\right)\)
Mà \(n_{HClbd}=1,6\left(mol\right)\)
\(\Rightarrow n_{HCldu}=0,6\left(mol\right)\)
Lại có : \(m_{ddsau}=m_{hh}+m_{ddHCl}-m_{hhkhi}=33+880-0,15.2-0,35.44=897,3\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,5.\left(24+71\right)}{897,3}.100\%\approx5,3\%\\C\%_{HCldu}=\dfrac{0,6\left(35,5+1\right)}{897,3}.100\%\approx2,44\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Tính thể tích khí H2 ở đktc để điều chế đc khi cho: a) 13g kẽm tác dụng hết vs dung dịch H2SO4 loãng. b ) dung dịch chứa 0.1mol axit HCl tác dụng vs sắt dư
Zn+2H2SO4->ZnSO4+H2
0,2----------------------------0,2
n Zn=\(\dfrac{13}{65}\)=0,2 mol
=>VH2=0,2.22,4=4,48l
b)
Fe+2HCl->FeCl2+H2
0,1--------------0,05 mol
=>VH2=0,05.22,4=1,12l
Đúng 1
Bình luận (0)
\(a,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b,Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{HCl}=0,1\left(mol\right)\Rightarrow n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\)
Đúng 1
Bình luận (0)
Pha 1000ml HCl 1M. Thể tích HCl đậm đặc (C%=36,6% , d=1,1g/ml) cần lấy là? biết H=1 , Cl=35,5
Ta có: nHCl = 1.1 = 1 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{1.36,5}{36,6\%}=\dfrac{18250}{183}\left(g\right)\)
\(\Rightarrow V_{ddHCl}=\dfrac{m_{ddHCl}}{1,1}\approx90,66\left(ml\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 21,6 g hỗn hợp Fe và Fe2 O3 bằng dung dịch HCl 10% D=1,1g/ml sau phản ứng thu được 2,24 lít khí H2 điều kiện chuẩn Tính nồng độ mol lít của dung dịch muối FeCl3 trong dung dịch sau phản ứng(coi thể tích dung dịch thay đổi không đáng kể )
Xem chi tiết
\(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=16\left(g\right)\)
\(\Rightarrow n_{Fe}=2n_{Fe_2O_3}=0,2\left(mol\right)=n_{FeCl_3}\)
Lại có : \(n_{HCl}=2n_{H_2}+3n_{FeCl_3}=0,8\left(mol\right)\)
\(\Rightarrow m_{ddHCl}=292\left(g\right)\)
\(\Rightarrow V=\dfrac{2920}{11}\left(ml\right)=\dfrac{73}{275}\left(l\right)\)
\(\Rightarrow C_{MFeCl_3}=\dfrac{0,2}{\dfrac{73}{275}}=\dfrac{55}{73}\left(M\right)\)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 21,6 g hỗn hợp Fe và Fe2 O3 bằng dung dịch HCl 10% D=1,1g/ml sau phản ứng thu được 22,4 lít khí H2 điều kiện chuẩn Tính nồng độ mol lít của dung dịch muối FeCl3 trong dung dịch sau phản ứng(coi thể tích dung dịch thay đổi không đáng kể )
Xem chi tiết
\(n_{H_2} = 1(mol)\)
Fe + 2HCl → FeCl2 + H2
1.........2.......................1.............(mol)
⇒ mFe = 1.56 = 56 > mhỗn hợp = 21,6
(Sai đề)
Đúng 0
Bình luận (0)
Để hòa tan m gam kẽm cần vừa đủ 50 gam dung dịch HCl 7,3 %
a/ Viết PTPƯ
b/ Tính m
c/ Tính thể tích khí thu được ở đktc?
d/ Tính khối lượng muối tạo thành sau phản ứng ?
( Biết Zn = 65 , H = 1, Cl = 35,5 )
\(m_{HCl}=50.7,3\%=3,65\left(g\right)\\ n_{HCl}=\dfrac{3,65}{36,5}=0,1\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{H_2}=n_{ZnCl_2}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\\ m_{Zn}=0,05.65=3,25\left(g\right)\\ V_{H_2\left(ĐKTC\right)}=0,05.22,4=1,12\left(l\right)\\ m_{ZnCl_2}=0,05.136=6,8\left(g\right)\)
Đúng 4
Bình luận (0)
mHCl=50.7,3%=3,65(g) -> nHCl=0,1(mol)
a) PTHH: Zn + 2 HCl -> ZnCl2 + H2
nH2=nZnCl2=nZn=nHCl/2= 0,1/2=0,05(mol)
b) m=mZn=0,05.65=3,25(g)
c) V(H2,đktc)=0,05.22,4=1,12(l)
d) mZnCl2= 136.0,05= 7,8(g)
Đúng 2
Bình luận (1)