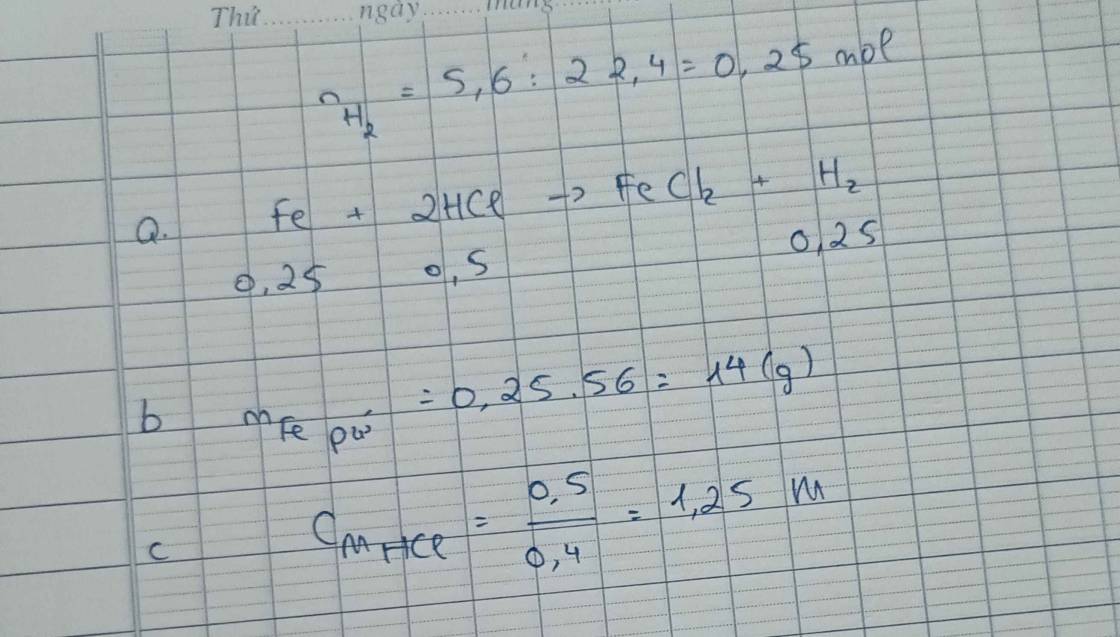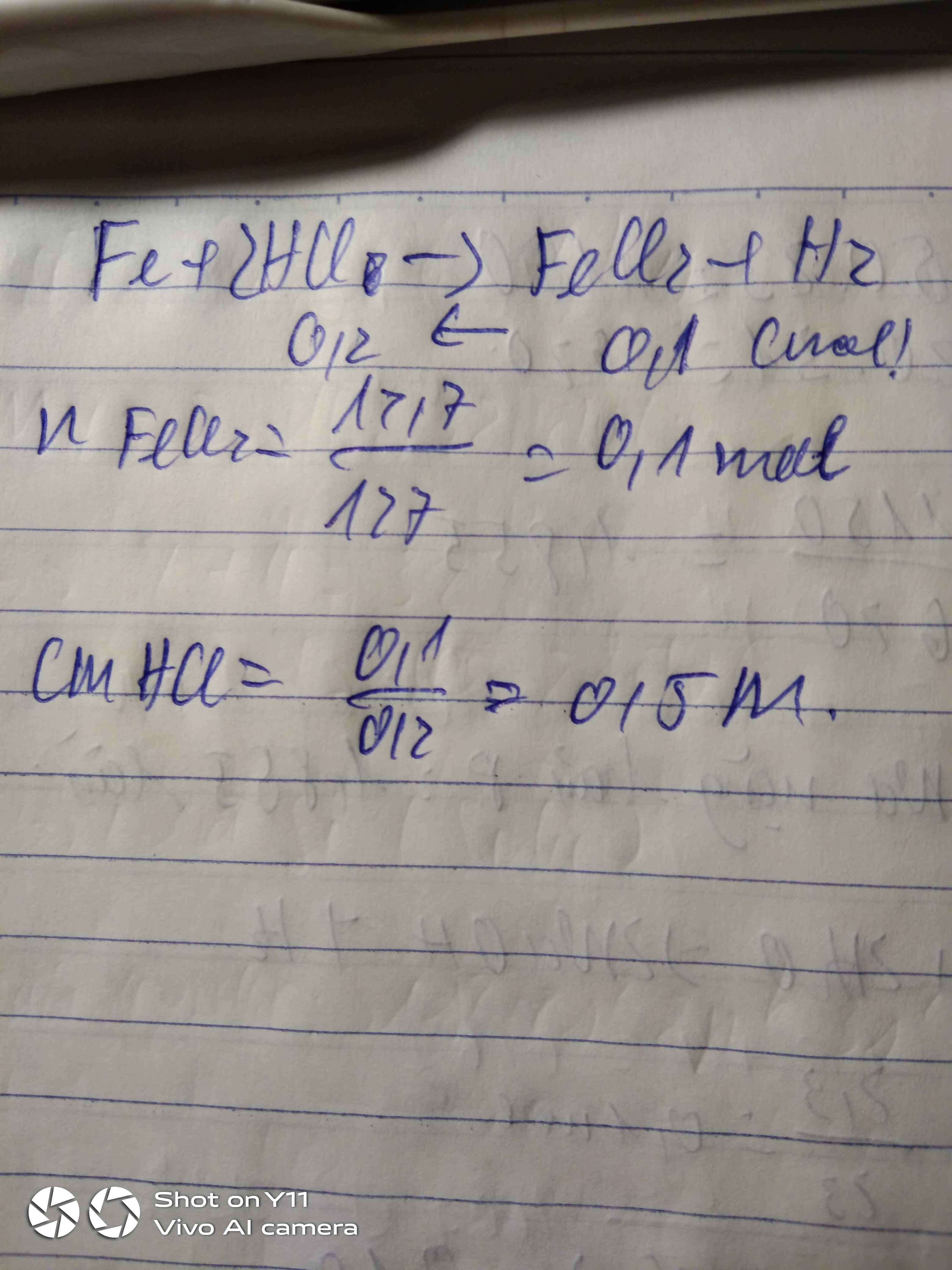Hoà tan một lượng sắt vào 400 ml dung dịch HCl vừa đủ. Sau phản ứng thu được 3,7185 lít khí hiđrô (đkc: 250C, 1 bar). Nồng độ M của dung dịch HCl là:

Những câu hỏi liên quan
Câu 4: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axít đã phản ứng là: Câu 5: Hoà tan một lượng sắt vào 400ml dung dịch HCl vừa đủ. Sau phản ứng thu được 3,36 lít khí hidrô (đktc). Nồng độ M của dung dịch HCl là: Câu 6: Cho 9,6 gam kim loại Magie vào 120 gam dung dịch HCl (vừa đủ). Nồng độ phần trăm của dung dịch sau phản ứng là :Help pls !!!!!!!!!!!!
Đọc tiếp
Câu 4: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axít đã phản ứng là:
Câu 5: Hoà tan một lượng sắt vào 400ml dung dịch HCl vừa đủ. Sau phản ứng thu được 3,36 lít khí hidrô (đktc). Nồng độ M của dung dịch HCl là:
Câu 6: Cho 9,6 gam kim loại Magie vào 120 gam dung dịch HCl (vừa đủ). Nồng độ phần trăm của dung dịch sau phản ứng là :
Help pls !!!!!!!!!!!!
Câu 4:
Tính khối lượng của H2SO4 có trong dung dịch:
m = n x M x V
Trong đó:
n = 0,4 mol (số mol của H2SO4)
M = 98g/mol (khối lượng mol của H2SO4)
V = 200g (thể tích của dung dịch)
m = 0,4 mol x 98g/mol x 200g / 1000g = 7,84g
% = (khối lượng H2SO4 / khối lượng dung dịch) x 100 % = (7,84g / 200g) x 100 = 3,92% Vậy nồng độ % của dung dịch axít đã phản ứng là 3,92%.
Đúng 1
Bình luận (1)
C6
Mg + 2HCl -> MgCl2 + H2
m = n x M
n = m / M
Trong đó:
m = 9,6g (khối lượng của Mg)
M = 24,31g/mol (khối lượng mol của Mg)
n = 9,6g / 24,31g/mol = 0,395 mol
Mg + 2HCl -> MgCl2 + H2
Tỷ lệ phản ứng của Mg và HCl là 1:2, vì vậy số mol của HCl là 2 x 0,395 mol = 0,79 mol.
Để tính khối lượng của dung dịch sau phản ứng, ta cần biết khối lượng riêng của dung dịch HCl. Với dung dịch HCl có nồng độ 36,5%, khối lượng riêng xấp xỉ là 1,18 g/mL.
V = m / rho
V = 120g / 1,18 g/mL = 101,69 mL (thể tích của dung dịch)
m (HCl) = 0,79 mol x 36,5g/mol = 28,835 g (khối lượng của HCl sau phản ứng)
M (dung dịch sau phản ứng) = m + M(H2O) = 28,835g + 72g = 100,835g
% = (khối lượng chất tan / khối lượng dung dịch) x 100
% = (28,835g / 100,835g) x 100 = 28,62%
Vậy nồng độ phần trăm của dung dịch sau phản ứng là 28,62%.
Đúng 1
Bình luận (1)
`C4:`
`n_[Fe]=[22,4]/56=0,4(mol)`
`Fe+H_2 SO_4 ->FeSO_4 +H_2 \uparrow`
`0,4` `0,4` `(mol)`
`C%_[H_2 SO_4]=[0,4.98]/200 .100=19,6%`
`C5:`
`n_[H_2]=[3,36]/[22,4]=0,15(mol)`
`Fe+2HCl->FeCl_2 +H_2 \uparrow`
`0,3` `0,15` `(mol)`
`C_[M_[HCl]]=[0,3]/[0,4]=0,75(M)`
`C6:`
`n_[Mg]=[9,6]/24=0,4(mol)`
`Mg+2HCl->MgCl_2 +H_2 \uparrow`
`0,4` `0,8` `(mol)`
`C%_[HCl]=[0,8.36,5]/120 .100=24,3%`
Đúng 3
Bình luận (1)
Xem thêm câu trả lời
Hoà tan một lượng sắt vừa đủ vào dung dịch HCl thu được 400ml dung dịch muối 2M và 1 lượng khí thoát ra a. Viết pt phản ứng xảy ra b.tính khối lượng kẽm tham gia phản ứng c.tính thể tích khí hiđro (đktc) d.tính nồng độ mol của dung dịch HCl cần dùng (cho rằng thể tích dung dịch thay đổi không đáng kể)
a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b, Có lẽ phần này đề hỏi khối lượng sắt chứ bạn nhỉ?
\(n_{ZnCl_2}=0,4.2=0,8\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{FeCl_2}=0,8\left(mol\right)\Rightarrow m_{Fe}=0,8.56=44,8\left(g\right)\)
c, \(n_{H_2}=n_{FeCl_2}=0,8\left(mol\right)\Rightarrow V_{H_2}=0,8.22,4=17,92\left(l\right)\)
d, \(n_{HCl}=2n_{FeCl_2}=1,6\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{1,6}{0,4}=4\left(M\right)\)
Đúng 2
Bình luận (0)
Hòa tan một lượng sắt vào 400 ml dung dịch HCl vừa đủ Sau phản ứng thu được 3,36 lít khí hidro nồng độ M của dung dịch HCl là
ĐỔI: 400ml= 0,4 l
nkhí H2= 3,36:22,4=0,15 mol
Fe+ 2HCl ----> FeCl2+H2
0,15 0,3 <---------------0,15
=> CM(HCl)= n:V=0,3 : 0,4 = 0,75 M
Đúng 0
Bình luận (0)
Cho một khối lượng mạt sắt dư vào 150mL dung dịch HCl. Sau phản ứng thu được 11,1555 lít khí (đkc)
a/ Viết PTHH. Tính khối lượng mạt sắt tham gia phản ứng
b/ Tính nồng độ mol của dung dịch HCl đã dùng
c/ Tính nồng độ mol dung dịch thu được
Hòa tan một lượng sắt vào 500ml dd HCl thì vừa đủ. Sau phản ứng thu được 4,48 lít khí h2 (đktc). Nồng độ mol của dung dịch HCl là:
GIẢI CHI TIẾT NHA MN !ĐỪNG GHI ĐÁP ÁN KO :)))
\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:\(2Fe+6HCl\rightarrow2FeCl_3+3H_2\)
0,1 0,4 0,1 0,2
\(CM_{HCl}=\dfrac{n_{ct}}{V_{dd}}=\dfrac{0,4}{0,5}\)=0,8(M)
Đúng 2
Bình luận (0)
cho m gam Zn vào 150 ml dung dịch HCL vừa đủ . Sau phản ứng thu được 3,36 lít khí H2 (đktc)
a) Tìm m b) Tính nồng độ mol của dung dịch HCL c) Tính khối lượng muối tạo thành\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{ZnCl_2}=n_{Zn}=n_{H_2}=0,15\left(mol\right);n_{HCl}=2.0,15=0,3\left(mol\right)\\ a,m=m_{Zn}=0,15.65=9,75\left(g\right)\\ b,C_{MddHCl}=\dfrac{0,3}{0,15}=0,2\left(l\right)\\ c,m_{ZnCl_2}=0,15.136=20,4\left(g\right)\)
Đúng 3
Bình luận (0)
Câu 6: Cho một lượng mạt sắt dư vào 400 ml dung dịch HCl. Phản ứng xong, thu được 5,6 lít khí (đktc).a) Viết phương trình phản ứng.b) Tính khối lượng mạt sắt đã phản ứng.c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Đọc tiếp
Câu 6: Cho một lượng mạt sắt dư vào 400 ml dung dịch HCl. Phản ứng xong, thu được 5,6 lít khí (đktc).
a) Viết phương trình phản ứng.
b) Tính khối lượng mạt sắt đã phản ứng.
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Hòa tan một lượng sắt vừa đủ trong 200 ml dung dịch HCl thu được dung dịch chứa 12,7 gam chất tan và khí H2. Nồng độ mol của dung dịch HCl là
Ta có PT: Fe + 2HCl ---> FeCl2 + H2.
Ta có: \(n_{FeCl_2}=\dfrac{12,7}{127}=0,1\left(mol\right)\)
Theo PT: nHCl = \(2.n_{FeCl_2}=2.0,1=0,2\left(mol\right)\)
=> mHCl = 0,2 . 36,5 = 7,3(g)
Đổi 200ml = 0,2 lít
Ta có: \(C_{M_{HCl}}=\dfrac{7,3}{0,2}=36,5\)(g/mol)
Đúng 2
Bình luận (1)
Cho 6,5 gam bột Zinc (Zn) tác dụng vừa đủ với 50 ml dung dịch sulfuric acid (H2SO4) loãng, sau phản ứng thu được 3,7185 lít khí hydrogen (đkc). a. Viết PTHH xảy ra? b. Tính nồng độ mol/lít của dung dịch acid đã dùng? c. Tính khối khối lượng muối thu được sau phản ứng?