Tinh chế N2 từ hỗn hợp N2, NO, NH3 hơi nước chỉ bằng 1 hoá chất khác
Tinh chế N2 từ hỗn hợp N2 , NO, NH3 , hơi nước chỉ bằng 2 hóa chất khác
Tham Khảo
Đầu tiên sục hỗn hợp này qua dd FeSO4 lấy dư :
FeSO4 +NO --> [Fe(NO)]SO4(dd)
FeSO4 + 2H2O + 2NH3 --> (NH4)2SO4(dd) + Fe(OH)2 (kt)
Thu khí thoát ra cho đi qua H2SO4 đặc để làm khô H20
Trình bày phương pháp tinh chế CO2 từ hỗn hợp chất rắn N2, CO, H2, N2, CO2, SO2
- Dẫn hỗn hợp khí qua dd Br2 dư, khí thoát ra gồm N2, CO, H2,CO2
\(SO_2+Br_2+2H_2O\rightarrow H_2SO_4+2HBr\)
- Dẫn hh khí thoát ra qua dd Ca(OH)2 dư, thu được kết tủa là CaCO3
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
- Lọc và nung kết tủa, khí thoát ra là CO2
\(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
Hỗn hợp X gồm N2 và H2 có tỉ khối hơi so với H2 là 3,6. Cho hỗn hợp X vào bình kín với xúc tác thích hợp rồi thực hiện phản ứng tổng hợp NH3 thấy thu được hỗn hợp Y gồm N2, H2 và NH3. Biết tỉ khối hơi của Y so với H2 bằng 4. Hiệu suất phản ứng tổng hợp NH3 trong phản ứng trên là
A. 30%.
B. 15%.
C. 20%.
D. 25%.
A là 8,96 lít hỗn hợp khí gồm N2 và H2 có tỉ khối hơi so với O2 bằng 17/64, cho A vào một bình kín có chất xúc tác thích hợp rồi đun nóng thì thu được hỗn hợp khí B gồm N2 , H2 , NH3 có thể tích 8,064 lít (biết các thể tích khí đều được đo ở đktc).
1. Tính hiệu suất của quá trình tổng hợp amoniac
2. % theo thể tích của mỗi khí trong hỗn hợp khí B
Cho hỗn hợp gồm các chất khí sau: N2, CO2, CO, O2 và hơi nước . Làm sao để tách riêng N2 ở dạng tinh khiết ra khỏi hỗn hợp
Làm vs ạ❤
cho qua CuO nóng dư để chuyển Co về CO2
CO + CuO --to--> Cu + CO2
sục vào kiềm dư để hấp thụ CO2 (có cả CO đã chuyển về CO2) và hoi nước tốt nhất nên chọn NạOH vì nó là dd kiềm ko bay hơi
CO2 + 2NaOH -> Na2CO3 + H2O
Cho hh khí còn lại đi qua Cu nóng đỏ dư thu dc ở bước làm đầu tiên (tiết kiệm nguyên liệu)
2Cu + O2 --> 2CuO
khí thoát ra là N2 tinh khiết
Cho qua Cu nóng dư để chuyển CO về CO2
CO + CuO --to---> Cu + CO2
Sục vào kiềm dư để hấp thụ CO2 (có cả CO đã chuyển về CO2) và hơi nước nên chọn NaOH vì nó là dung dịch kiềm không bay hơi
CO2 + 2NaOH ----> Na2CO3 + H2O
Cho hỗn hợp khí còn lại đi qua Cu nóng đỏ dư để thu được ở bước đầu tiên ( tiết kiệm nguyên liệu)
2Cu + O2 ----> 2CuO
Vậy kí thoát ra là khí N2 tinh khiết
Tính tỉ khối hơi của các hỗn hợp sau:
(0,15 mol NH3 và 0,5 mol PH3) so với (0,2 mol N2 và 0,1 mol NO)
Gọi 2 hh trên lần lượt là A và B
\(M_A=\dfrac{0,15.17+0,5.34}{0,15+0,5}=30\left(\dfrac{g}{mol}\right)\\ M_B=\dfrac{0,2.28+0,1.30}{0,2+0,1}=29\left(\dfrac{g}{mol}\right)\)
dA/B = \(\dfrac{30}{29}=1,1\)
Dãy nào dưới đây gồm các chất chứa nguyên tử nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính oxi hoá khi tham gia phản ứng?
A. N H 3 , N 2 O 5 , N 2 , N O 2
B. N H 3 , NO, H N O 3 , N 2 O 5
C. N 2 , NO, N 2 O , N 2 O 5
D. N O 2 , N 2 , NO, N2O3
1. Đốt cháy hoàn toàn 1,1g hợp chất A thu được 2,2g cacbon dioxit và 0,9g nước. Xác định công thức hóa học của A. Biết 0,7 lít hơi của nó qui về đktc có khối lượng 2,75g
2. Hỗn hợp X gồm H2, N2 có tỉ khối so với khí hidro bằng 3,6. Đun nóng hỗn hợp X với chất xúc tác thích hợp ( xảy ra phản ứng theo sơ đồ : N2 + H2 = NH3 ), sau một thời gian thu được hỗn hợp Y có tỉ khối so với khí hidro bằng 4,5. Tính hiệu suất của phản ứng tổng hợp NH3. Biết các khí đo ở cùng điều kiện về nhiệt độ và áp suất.
Điều chế N H 3 từ hỗn hợp hồm N 2 v à H 2 (tỉ lệ 1 : 3) . Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là
A. 25%.
B. 40%.
C. 10%.
D. 20%.
Chọn D
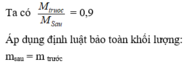
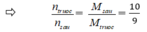
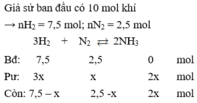
(Do ban đầu số mol N2 : H2 = 1 : 3 → hiệu suất tính theo H2 hoặc N2)
Sau phản ứng n = nH2 + nN2 + nNH3 = 7,5 - 3x + 2,5 – x + 2x = 10 – 2x = 9
→ x = 0,5 ⇒ H% = (0,5/2,5). 100% = 20%