CHƯƠNG III: MOL VÀ TÍNH TOÁN HÓA HỌC
Hỏi đáp
Theo ĐLBT KL, có: mMg + mO2 = mMgO
⇒ mO2 = 8,8 - 2,4 = 6,4 (g)
Đúng 1
Bình luận (3)
1.Tính khối lượng mol của một phân tử x biết
a) 0.01 mol x có khối lượng là 1 g
b) 1.2395 lít I ở đkc có khối lượng 3.2g
2. Cho 2.7 AL tác dụng với dung dịch chứa 14.6 g HCL thu được ALCL3 và H2.Tính thể tích H2 thu được ở đkc
\(1.\\ a)M_x=\dfrac{1}{0,01}=100g/mol\\ b)n=\dfrac{1,2395}{24,79}=0,05mol\\ M=\dfrac{3,2}{0,05}=64\\ 2.\\ n_{Al}=\dfrac{2,7}{27}=0,1mol\\ n_{HCl}=\dfrac{14,6}{36,5}=0,4mol\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\dfrac{0,1}{2}< \dfrac{0,4}{6}\Rightarrow HCl.dư\\ n_{H_2}=\dfrac{0,1.3}{2}=0,15mol\\ V_{H_2}=0,15.24,79=3,7185l\)
Đúng 3
Bình luận (0)
cho10 g Hỗn hợpkim loại Al , Mg , Cu hòa tan bằng HCl dư thu đc 9,916 dm3 khí ( điều kiện chuẩn ) và được dung dịch A cùng chất rắn B . Lọc và nung B trong không khí đến lượng không đổi cân nặng 2,75g . Tính % lượng mỗi kim loại.Đốt cháy hết 10g hh trên ,tìm.thể tích của oxit cần dung đkc
\(n_{CuO}=\dfrac{2,75}{80}=0,034375mol\\ 2Cu+O_2\rightarrow2CuO\)
0,034375 0,0171875 0,034375
\(m_{Al,Mg}=10-0,034375.64=7,8g\\ n_{H_2}=\dfrac{9,916}{22,79}=0,4mol\\ n_{Al}=a;n_{Mg}=b\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+24b=7,8\\1,5a+b=0,4\end{matrix}\right.\\ \Rightarrow a=0,2;b=0,1\\ \%m_{Al}=\dfrac{27.0,2}{10}\cdot100=54\%\\ \%m_{Mg}=\dfrac{0,1.24}{10}\cdot1=24\%\\ \%m_{Cu}=100-54-24=22\%\\ 4Al+3O_2\xrightarrow[]{t^0}2Al_2O_3\left(2\right)\\ n_{O_2\left(2\right)}=\dfrac{0,2.3}{4}=0,15mol\\ 2Mg+O_2\xrightarrow[]{t^0}2MgO\left(3\right)\\ n_{O_2\left(3\right)}=\dfrac{0,1}{2}=0,05mol\\ V_{O_2}=\left(0,0171875+0,15+0,05\right).24,79\approx5,384l\)
Đúng 3
Bình luận (0)
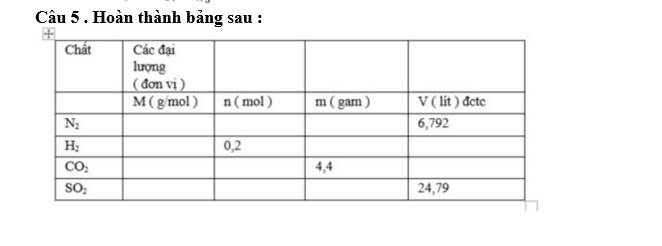
| Chất | Các đại lượng (đơn vị) | |||
| M (g/mol) | n (mol) | m (gam) | V (lít) | |
| N2 | 28 | 0,274 | 7,672 | 6,792 |
| H2 | 2 | 0,2 | 0,4 | 4,958 |
| CO2 | 44 | 0,1 | 4,4 | 2,479 |
| SO2 | 64 | 1 | 64 | 24,79 |
Đúng 1
Bình luận (0)
tich B Đơn vị Tính được khi Câu 1. Cho các sơ đồ phản ứng sau: (a) Mg + HCl −→→ MgCl2 + H2 (b) Fe2O3 + HCl = FeCl3 + H2O (c) Al + HCl → AICI 3 + H2 CO2 + H2O (e) BaCl2 + AgNO3 → Ba(NO3)2 + AgCl (d) C2H6+ O2 (f) Al2(SO4)3 + Ba(OH)2 → Al2(SO4)3 + BaSO4 (g) Cu+ H2SO4 CuSO4 + SO2 + H2O (h) FeS2 + O2 --→ Fe2O3 + SO2 ) K2Cr2O7+ HCI KCl + CrCl3 + Cl2 + H2O
Đốt cháy 5,6g Iron trong V lít khí O2 thu được a g Fe3O4
a. Lập phương trình hóa học
b. Tính a g Fe3O4
c. Tính V khí O2
\(a,3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\ b,n_{Fe_3O_4}=\dfrac{1}{3}.0,1=\dfrac{1}{30}\left(mol\right)\\ a=m_{Fe_3O_4}=\dfrac{232}{30}=\dfrac{116}{15}\left(g\right)\\ c,n_{O_2}=\dfrac{2}{3}.0,1=\dfrac{1}{15}\left(mol\right)\\ V=V_{O_2\left(đkc\right)}=\dfrac{1}{15}.24,79=1,65266667\left(l\right)\)
Đúng 4
Bình luận (0)
Để trung hòa hết 50 ml dung dịch NaOH 1M cần dùng vừa đủ x gam dung dịch H2SO4 19,6% giá trị của x là bao nhiêu
\(n_{NaOH}=0.05\cdot1=0.05\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
\(0.05...........0.025\)
\(m_{dd_{H_2SO_4}}=\dfrac{0.025\cdot98}{19.6\%}=12.5\left(g\right)\)
Đúng 2
Bình luận (1)
Cho 1lượng mạt sắt dư vào 250ml dung dịch HCL sau phản ứng thu được 9,9161 khí (đktc) a) viết phương trình hóa học b) tính khối lượng mạt sắt tham gia phản ứng b) tính nồng đọ mol của dung dịch đã dùng
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe}=n_{H_2}=\dfrac{9,9161}{24,79}\approx0,4\left(mol\right)\\ b,m_{Fe}\approx0,4.56\approx22,4\left(g\right)\\ c,n_{HCl}\approx0,4.2\approx0,8\left(mol\right)\\ C_{MddHCl}\approx\dfrac{0,8}{0,25}\approx3,2\left(M\right)\)
Đúng 2
Bình luận (0)
\(a)Fe+2HCl\rightarrow FeCl_2+H_2\\ b)n_{H_2}=\dfrac{9,9161}{24,79}\approx0,4mol\\ n_{Fe}=n_{H_2}=0,4mol\\ m_{Fe}=0,4.56=22,4g\\ c)n_{HCl}=2n_{H_2}=2.0,4=0,8mol\\ 250ml=0,25l\\ C_{M_{HCl}}=\dfrac{0,8}{0,25}=3,2M\)
Đúng 0
Bình luận (0)
Tỉ khối của khí B đối với oxi là 0,25 và tỉ khối của khí A đối với khí B là 2,5. Khối lượng mol của khí A là
Xem chi tiết
Ta có: \(d_{B/O_2}=\dfrac{M_B}{M_{O_2}}=0,25\Rightarrow M_B=0,25.32=8\left(g/mol\right)\)
\(d_{A/B}=\dfrac{M_A}{M_B}=2,5\Rightarrow M_A=2,5.M_B=20\left(g/mol\right)\)
Đúng 2
Bình luận (0)
Ở điều kiện chuẩn 7.437 lít khí CO2 có số mol
\(n_{CO2\left(dkc\right)}=\dfrac{7,437}{24,79}=0,3\left(mol\right)\)
Đúng 1
Bình luận (0)