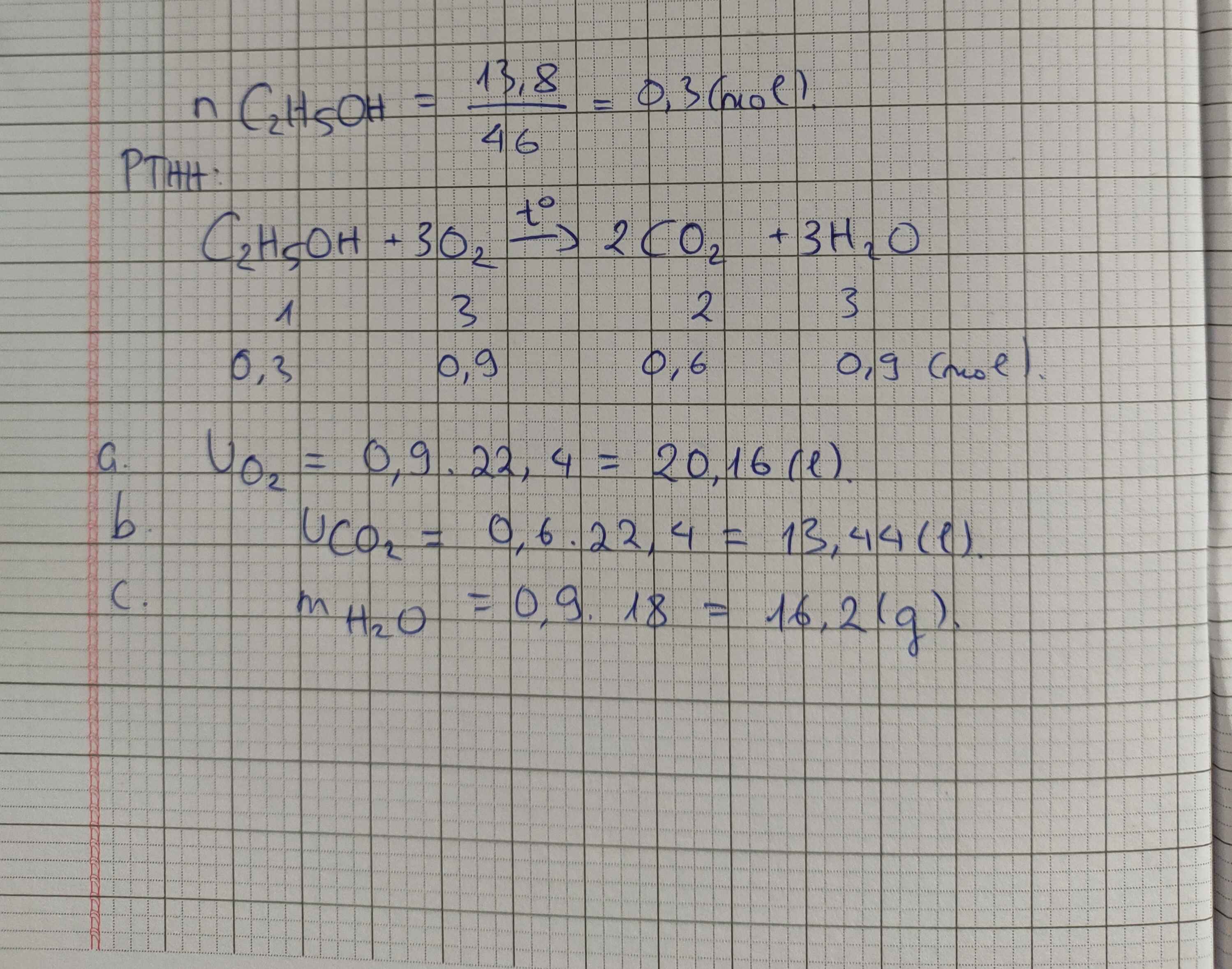Đốt cháy hoàn toàn 4,8 l khí c2h4( đktc) thu được khí cacbonic và hơi nước .a viết ptpu.b tính V nước cần dùng (đktc).c cho lượng khí etylen trên tác dụng với nước có axit làm xúc tác thu được 6,9g rượu etylic. Tính hiệu suất phản ứng

Những câu hỏi liên quan
Đốt cháy hoàn toàn 4,6 gam rượu etylic trong oxi thu được khí cacbonđioxit và hơi nước. a. Viết phương trình hóa học xảy ra? b. Tính thể tích khí oxi (ở đktc) cần dùng ? c. Tính khối lượng khí cacbonic và khối lượng hơi nước tạo thành?
a) $C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b) $n_{C_2H_5OH} = \dfrac{4,6}{46} = 0,1(mol)$
$n_{O_2} = 3n_{C_2H_5OH} = 0,3(mol)$
$V_{O_2} = 0,3.22,4 = 6,72(lít)$
c)
Theo PTHH :
$n_{CO_2} = 2n_{C_2H_5OH} = 0,2(mol) \Rightarrow V_{CO_2} = 0,2.22,4 = 4,48(lít)$
$n_{H_2O} = 3n_{C_2H_5OH} = 0,3(mol) \Rightarrow m_{H_2O} = 0,3.18 = 5,4(gam)$
Đúng 2
Bình luận (0)
đốt cháy hoàn toán 28 lít khí metan trong không khí thu được khí cacbonic và hơi nước
a) viết phương trình hóa học
b) tính khối lượng khí cacbonic thu được
c) tính thể tích khí oxi cần dùng . Biết các chất khí được đo ở đktc
a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
b, \(n_{CH_4}=\dfrac{28}{22,4}=1,25\left(mol\right)\)
\(n_{CO_2}=n_{CH_4}=1,25\left(mol\right)\Rightarrow m_{CO_2}=1,25.44=55\left(g\right)\)
c, \(n_{O_2}=2n_{CH_4}=2,5\left(mol\right)\Rightarrow V_{O_2}=2,5.22,4=56\left(l\right)\)
Đúng 1
Bình luận (0)
a)cho 2;24 lít khí hiđro (đktc)đã tinh khiết cháy trong không khí hoàn toàn .Tính lượng hơi nước sinh ra từ phản ứng trên ? b)cho lượng nước trên tác dụng với 3,45 gam kim loại natri ở nhiệt độ thường .Tính lượng khí H2 thu được ở đktc?
2H2+O2-to>2H2O
0,1----0,05----0,1mol
n H2=\(\dfrac{2,24}{22,4}=0,1mol\)
=>m H2O=0,1.18=1,8g
2Na+2H2O->2NaOH+H2
0,1----0,1-------0,1------0,05
n Na=\(\dfrac{3,45}{23}\)=0,15 mol
=>Na dư
=>VH2=0,05.22,4=1,12l
Đúng 5
Bình luận (1)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
\(nH_2=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(mH_2O=0,1.18=1,8\left(g\right)\)
\(H_2O+2Na\rightarrow Na_2O+H_2\uparrow\)
\(nNa=\dfrac{3,45}{23}=0,15\left(mol\right)\)
\(\dfrac{0,1}{1}>\dfrac{0,15}{2}\)
=> Na dư , H2O đủ
\(mH_2=0,1.22,4=2,24\left(l\right)\)
Đốt cháy hoàn toàn a(g) hợp chất X cần dùng 44,8 lít khí oxi (đktc) thu được V (lít) khí CO2 và b(g) nước. Cho b(g) hơi nước tác dụng hết với 124g Na2O. Tìm a biết khí CO2 và hơi nước tạo thành theo tỉ lệ số mol là 1:1
Ta cÓ PTHH :
H2O + Na2O \(\rightarrow\) 2NaOH
nNa2O = m/M = 124/62 = 2 (mol)
TheO PT : => nH2O = nNa2O = 2(mol)
Vì nCO2 : nH2O =1:1 => nCO2 = nH2O = 2(mol)
Do đó: mCO2 = n .M = 2 . 44 =88(g) và mH2O = n .M = 2 .18 =36(g)
nO2 = V/22.4 = 44.8/22.4 = 2(mol)
=> mO2 = n .M = 2 x 32 = 64(g)
Theo ĐLBTKL : mX + mO2 = mCO2 + mH2O
=> a + 64 = 88 + 36
=> a =60 (g)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 5.6 lít khí C2H4 ở đktc . Dẫn toàn bộ cháy khí thu được qua dung dịch nước vôi trong. a) Tính thể tích khí ôxi cần dùng (đktc) b) Tính khối lượng chất rắn thu được sau khi phản ứng kết thúc
a, \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Ta có: \(n_{C_2H_4}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=0,75\left(mol\right)\Rightarrow V_{O_2}=0,75.22,4=16,8\left(l\right)\)
b, Theo PT: \(n_{CaCO_3}=n_{CO_2}=2n_{C_2H_4}=0,5\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,5.100=50\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 13,8 gam rượu etylic cần dùng V lít oxi (ở đktc), sau phản ứng thu được khí cacbonic và nước.
a/ Tính thể tích oxi phản ứng.
b/ Tính thể tích khí cacbonic tạo thành.
c/ Tính khối lượng nước tạo thành.
Đốt cháy hoàn toàn khí metan trong bình chứa 8 gam khí oxi thu được khí cacbonic và nước.
a. Viết PTHH xảy ra.
b. Tính khối lượng metan tham gia phản ứng.
c. Tính thể tích khí cacbonic thu được ở đktc.
d. Dẫn hết lượng khí cacbonic sinh ra đi qua dung dịch nước vôi trong dư Ca(OH)2. Tính khối
lượng kết tủa thu được.
(H=1, C=12, O=16, Ca=40)
Xem chi tiết
\(n_{O_2}=\dfrac{8}{32}=0.25\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(0.125....0.25....0.125\)
\(m_{CH_4}=0.125\cdot16=2\left(g\right)\)
\(V_{CO_2}=0.125\cdot22.4=2.8\left(l\right)\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(............0.125.....0.125\)
\(m_{CaCO_3}=0.125\cdot100=12.5\left(g\right)\)
Đúng 3
Bình luận (0)
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 9,2g rượu etylic bởi oxi không khí thu được khí cacbonđioxit và hơi nước. a) Viết PTHH xảy ra b) Tính khối lượng cacbonđioxit và khối lượng hơi nước tạo thành c) Tính thể tích oxi và thể tích ( đktc) trong không khí thu được khí cacbonđioxit và hơi nước
a)
$C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b)
n C2H5OH = 9,2/46 = 0,2(mol)
n CO2 = 2n C2H5OH = 0,4(mol) => m CO2 = 0,4.44 = 17,6 gam
n H2O = 3n C2H5OH = 0,6(mol) => m H2O = 0,6.18 = 10,8 gam
c)
n O2 = 3n C2H5OH = 0,6(mol)
=> V O2 = 0,6.22,4 = 13,44(lít)
=> V không khí = 13,44/20% = 67,2 lít
Đúng 1
Bình luận (0)
Theo gt ta có: $n_{C_2H_5OH}=0,2(mol)$
a, $C_2H_5OH+3O_2\rightarrow 2CO_2+3H_2O$
b, Ta có: $n_{CO_2}=0,4(mol)\Rightarrow m_{CO_2}=17,6(g)$
$n_{H_2O}=0,6(mol)\Rightarrow m_{H_2O}=10,8(g)$
c, Ta có: $n_{O_2}=0,6(mol)\Rightarrow V_{O_2}=13,44(l)\Rightarrow V_{kk}=67,2(l)$
Đúng 1
Bình luận (0)