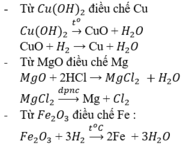Viets các phương trình phản ứng điều chế BaSO4 từ 5 phương pháp

Những câu hỏi liên quan
Từ Cu(OH)2, MgO, Fe2O3 hãy điều chế các kim loại tương ứng bằng phương pháp thích hợp. Viết phương trình hóa học của phản ứng.
Từ Cu(OH)2, MgO, Fe2O3 hãy điều chế các kim loại tương ứng bằng phương pháp thích hợp. Viết phương trình hóa học của phản ứng.
Viết phương trình hoá học của phản ứng điều chế H 3 P O 4 từ quặng apatit. Tại sao H 3 P O 4 điều chế bằng phương pháp này lại không tinh khiết ?
Phương trình hoá học của phản ứng điều chế H 3 P O 4 từ quặng apatit :
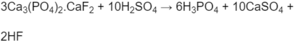
H 3 P O 4 điều chế bằng phương pháp này không tinh khiết, vì tất cả các tạp chất có trong quặng apatit tạo được muối sunfat hoặc photphat tan đều chuyển vào dung dịch H 3 P O 4 .
Đúng 0
Bình luận (0)
có những chất sau : sắt , lưu huỳnh , axit sunfuric loãng : a) hãy trình bày phương pháp điều chế hidro sunfua từ các chất trên ; b) viết các phương trình hóa học của phản ứng và cho biết vai trò của lưu huỳnh trong phản ứng .
PT:
Fe + S-->FeS (to)
FeS + H2SO4-->H2S + FeSO4
Vai trò:chất oxi hóa
Đúng 0
Bình luận (0)
1 Từ các chất rắn ban đầu: Al2O3, NaCl, PbO, Cu(NO3)2 . Hãy viết các phương trình phản ứng để điều chế các kim loại tương ứng: Al, Na, Pb, Cu bằng các phương pháp thích hợp, ghi rõ điều kiện phản ứng nếu có. 2. Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Al2O3 cần vừa đủ 250ml dung dịch KOH 2M. Nếu cũng cho m gam hỗn hợp trên vào dung dịch HNO3 loãng, dư thì thu được 0,56 lít khí N2O (đktc) và dung dịch X. Cô cạn X thu được 107,5 gam muối khan. Tìm giá trị của m?
Đọc tiếp
1 Từ các chất rắn ban đầu: Al2O3, NaCl, PbO, Cu(NO3)2 . Hãy viết các phương trình phản ứng để điều chế các kim loại tương ứng: Al, Na, Pb, Cu bằng các phương pháp thích hợp, ghi rõ điều kiện phản ứng nếu có.
2. Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Al2O3 cần vừa đủ 250ml dung dịch KOH 2M. Nếu cũng cho m gam hỗn hợp trên vào dung dịch HNO3 loãng, dư thì thu được 0,56 lít khí N2O (đktc) và dung dịch X. Cô cạn X thu được 107,5 gam muối khan. Tìm giá trị của m?
1. \(Al_2O_3\underrightarrow{^{đpnc}}2Al+\dfrac{3}{2}O_2\)
\(NaCl\underrightarrow{^{đpnc}}Na+\dfrac{1}{2}Cl_2\)
\(PbO+H_2\underrightarrow{t^o}Pb+H_2O\)
\(Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\)
Đúng 2
Bình luận (0)
2. Gọi: \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Al_2O_3}=b\left(mol\right)\\n_{NH_4NO_3}=c\left(mol\right)\end{matrix}\right.\)
- Cho pư với KOH: \(n_{KOH}=0,25.2=0,5\left(mol\right)\)
BTNT K, có: nKAlO2 = nKOH = 0,5 (mol)
BTNT Al, có: nAl + 2nAl2O3 = nKAlO2 ⇒ a + 2b = 0,5 (1)
- Cho pư với HNO3: \(n_{N_2O}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
BTNT Al có: nAl(NO3)3 = nAl + 2nAl2O3 = a + 2b (mol)
Mà: mAl(NO3)3 + mNH4NO3 = 107,5 (g)
⇒ 213(a+2b) + 80c = 107,5
⇒ 213a + 426b + 80c = 107,5 (2)
BT e, có: 3nAl = 8nN2O + 8nNH4NO3 ⇒ 3a = 8.0,025 + 8c (3)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,2\left(mol\right)\\c=0,0125\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m=m_{Al}+m_{Al_2O_3}=0,1.27+0,2.102=23,1\left(g\right)\)
Đúng 2
Bình luận (0)
Viết phương trình phản ứng điều chế FeCl3 FeSO4 Fe2(SO4)3 từ các chất FeS NaCl nước và các chất xúc tác cần thiết ko dùng thêm hóa chất khác các phương pháp tùy chọn
\(2NaCl \xrightarrow{t^o} 2Na + Cl_2\\ 2H_2O \xrightarrow{đp} 2H_2 + O_2\\ 4FeS + 7O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4SO_2\\ 2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3\\ SO_3 + H_2O \to H_2SO_4 2NaCl+ 2H_2O \xrightarrow{đpdd} 2NaOH + H_2 + Cl_2\\ H_2 + Cl_2 \xrightarrow{as} 2HCl\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\)
Đúng 1
Bình luận (0)
Có một hỗn hợp bột gồm K2O,Al2O3,BaO. Bằng phương pháp hóa học, hãy điều chế từng kim loại từ hỗn hợp các oxit trên và viết các phương trình phản ứng xảy ra
\(\left(K_2O,Al_2O_3,BaO\right)\underrightarrow{H_2O}\left(KOH,Ba\left(OH\right)_2\right),\left(Al_2O_3\right)\\ \left(Al_2O_3\right)\underrightarrow{dpnc}Al\\ \left(KOH,Ba\left(OH\right)_2\right)\underrightarrow{KHCO_3}\left(K_2CO_3,KHCO_3\right),\left(BaCO_3\right)\\ \left(BaCO_3\right)\underrightarrow{HCl}BaCl_2\underrightarrow{dp}Ba\\ \left(K_2CO_3,KHCO_3\right)\underrightarrow{HCl}\left(KCl\right)\underrightarrow{dp}K\\ K_2O+H_2O->2KOH\\ BaO+H_2O->Ba\left(OH\right)_2\\ Al_2O_3-dpnc->2Al+\dfrac{3}{2}O_2\\ KOH+KHCO_3->K_2CO_3+H_2O\\ Ba\left(OH\right)_2+2KHCO_3->BaCO_3+K_2CO_3+2H_2O\\ BaCO_3+2HCl->BaCl_2+H_2O+CO_2\\ BaCl_2-dp->Ba+Cl_2\\ K_2CO_3+2HCl->2KCl+H_2O+CO_2\\ KHCO_3+HCl->KCl+H_2O+CO_2\\ KCl-dp->K+\dfrac{1}{2}Cl_2\)
Đúng 1
Bình luận (0)
a. Từ MnO2, HCl đặc, Fe hãy viết các phương trình phản ứng điều chế Cl2, FeCl2 và FeCl3.
b. Từ muối ăn, nước và các thiết bị cần thiết, hãy viết các phương trình phản ứng điều chế Cl2 , HCl và nước Javel .
MnO2+4HCl->MnCl2+Cl2+H2O
Fe+2HCl->FeCl2+H2
2Fe+3CL2-to>2Fecl3
b)
2NaCl+2H2O-đp\comn>2NaOH+cl2+H2
H2+Cl2-as->2HCl
Cl2+2NaOH->NaCl+NaClO+H2O
Đúng 0
Bình luận (0)
a, Fe + 2HCl ---> FeCl2 + H2
MnO2 + 4HCl ---> MnCl2 + Cl2 + 2H2O
2Fe + 3Cl2 ---to---> 2FeCl3
b, 2NaCl ---đpnc---> 2Na + Cl2
2H2O ---đp---> 2H2 + O2
H2 + Cl2 ---as---> 2HCl
2Na + 2H2O ---> 2NaOH + H2
2NaOH + Cl2 ---đpkcmn---> NaCl + NaClO + H2O
Những chất mình in đậm là nữngc chất cần điều chế nha
Đúng 0
Bình luận (0)
bài 2
a. Từ MnO 2 , HCl đặc. Fe hãy viết các phương trình phản ứng điều chế Cl 2 , FeCl 2 và FeCl 3 .
b. Từ muối ăn, nước và các thiết bị cần thiết, hãy viết các phương trình phản ứng điều chế Cl 2 , HCl và
nước Javel
a)
\(MnO_2 + 4HCl \to MnCl_2 +C l_2 + 2H_2O\\ Fe + 2HCl \to FeCl_2 + H_2\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\)
b)
\(2NaCl + 2H_2O \xrightarrow{đpdd,cmn} 2NaOH + H_2 + Cl_2\\ 2NaOH + Cl_2 \to NaCl + NaClO + H_2O\\ H_2 + Cl_2 \xrightarrow{as} 2HCl\)
Đúng 2
Bình luận (0)