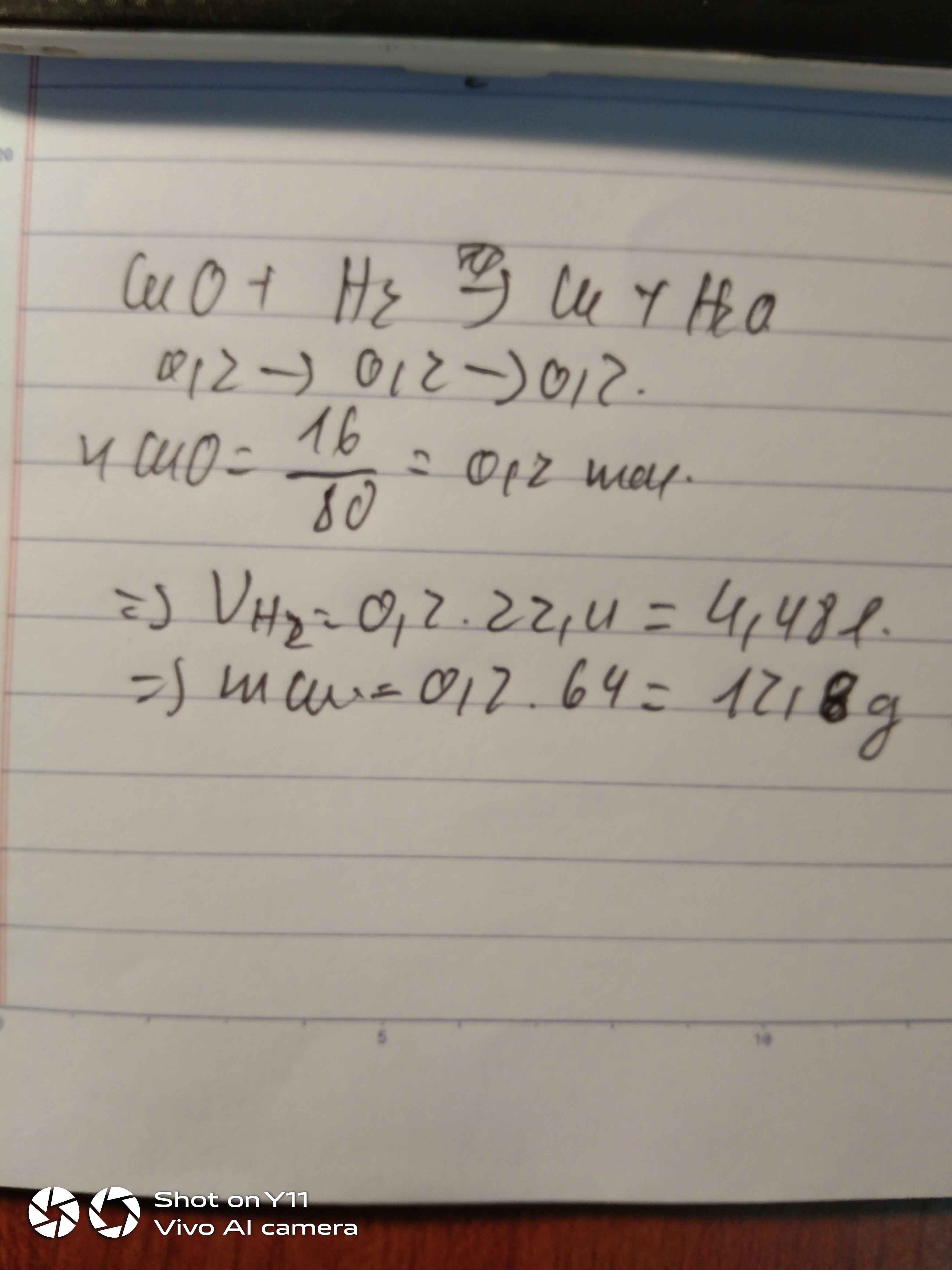Cho 4g copper(II) oxide(CuO) tác dụng với khí hydrogen. Tạo ra 2g copper. Tính hiệu suất phản ứng

Những câu hỏi liên quan
cho 7,2g Mg tan hoàn toàn trong dung dịch hydrochloric acid HCl.
a. Tính thể tích khí hydrogen sinh ra (đkc)
b. Tính khối lượng HCl tham gia phản ứng
c. Dẫn khí hydrogen vừa tạo thành đi qua 12g copper (II) oxide (CuO). Khí Hydrogen có khử hết copper (II) oxide CuO không?
giải giúp em câu c vớii ạ
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
PTHH:
Mg + 2HCl ---> MgCl2 + H2
0,3-->0,6----------------->0,3
=> \(\left\{{}\begin{matrix}V_{H_2}=24,79.0,3=7,437\left(l\right)\\m_{HCl}=0,6.36,5=21,9\left(g\right)\end{matrix}\right.\)
\(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
LTL: 0,15 < 0,3 => H2 dư, vậy H2 khử hết CuO
Đúng 2
Bình luận (1)
a, \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Mg + 2HCl -----> MgCl2 + H2
0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
CuO + H2 -----> Cu + H2O
Ta có: \(\dfrac{0,15}{1}< \dfrac{0,3}{1}\) ⇒ CuO hết, H2 dư
Đúng 1
Bình luận (1)
\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72l\\
m_{HCl}=0,6.36,5=21,9g\\
n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(ltl:0,15< 0,3\)
=> H2 có khử hết CuO
Đúng 1
Bình luận (0)
cho 7,2g Mg tan hoàn trong dd HCL.
a/Tính thể tích khí hydrogen sinh ra (đkc)
b/tính khối lượng HCL tham gia phản ứng
c/Dẫn khí hydrogen vừa tạo thành đi qua 12g copper (hóa trị 2) oxide (CuO).Khí hydrogen có khử hết copper hóa trị 2) oxide CuO không
Mg+2HCl->MgCl2+H2
0,3---0,6-----0,3----0,3
n Mg=0,3 mol
=>VH2=0,3.24,79=8,247 l
=>m HCl=0,6.36,5=21,9g
c)H2+CuO-to>Cu+H2O
0,15-----0,15
n CuO=0,15 mol
=>H2 dư -> CuO dheets
=>m Cu=0,15.64=9,6g
Đúng 3
Bình luận (0)
Khử 16g Copper(II) oxide (CuO ) bằng khí hydrogen (H2 ) a.Tính thể tích khí hydrogen (H2 ) tham gia phản ứng? b. Tính khối lượng kim loại tạo thành? Fe= 56, O=16, Cu=64, H=1
Câu 8: Nhiệt phân copper(II) nitrate Cu(NO3)2 thu được copper(II) oxide CuO, nitrogen dioxide NO2 và khí oxygen O2.a. Lập phương trình hóa học của phản ứng. b. Nếu nhiệt phân hoàn toàn 28,2 gam copper(II) nitrate với hiệu suất phản ứng 100% thì thu được bao nhiêu gam copper(II) oxide và bao nhiêu lít khí oxygen ở đkc?c. Muốn thu được 6,1975 lít (đkc) hỗn hợp 2 khí NO2 và O2 thì phải nhiệt phân bao nhiêu gam copper(II) nitrate, biết hiệu suất phản ứng đạt 80%.
Đọc tiếp
Câu 8: Nhiệt phân copper(II) nitrate Cu(NO3)2 thu được copper(II) oxide CuO, nitrogen dioxide NO2 và khí oxygen O2.
a. Lập phương trình hóa học của phản ứng.
b. Nếu nhiệt phân hoàn toàn 28,2 gam copper(II) nitrate với hiệu suất phản ứng 100% thì thu được bao nhiêu gam copper(II) oxide và bao nhiêu lít khí oxygen ở đkc?
c. Muốn thu được 6,1975 lít (đkc) hỗn hợp 2 khí NO2 và O2 thì phải nhiệt phân bao nhiêu gam copper(II) nitrate, biết hiệu suất phản ứng đạt 80%.
a, \(2Cu\left(NO_3\right)_2\underrightarrow{t^o}2CuO+4NO_2+O_2\)
b, \(n_{Cu\left(NO_3\right)_2}=\dfrac{28,2}{188}=0,15\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{CuO}=n_{Cu\left(NO_3\right)_2}=0,15\left(mol\right)\\n_{O_2}=\dfrac{1}{2}n_{Cu\left(NO_3\right)_2}=0,075\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{CuO}=0,15.80=12\left(g\right)\)
\(V_{O_2}=0,075.24,79=1,85925\left(l\right)\)
c, Ta có: \(n_{NO_2}+n_{O_2}=\dfrac{6,1975}{24,79}=0,25\left(mol\right)\)
Gọi: nO2 = x (mol)
Theo PT: \(n_{NO_2}=4n_{O_2}=4x\left(mol\right)\)
⇒ 4x + x = 0,25 ⇒ x = 0,05 (mol)
Theo PT: \(n_{Cu\left(NO_3\right)_2\left(LT\right)}=2n_{O_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu\left(NO_3\right)_2\left(LT\right)}=0,1.188=18,8\left(g\right)\)
Mà: H = 80% \(\Rightarrow m_{Cu\left(NO_3\right)_2\left(TT\right)}=\dfrac{18,8}{80\%}=23,5\left(g\right)\)
Đúng 5
Bình luận (0)
Hòa tan hoàn toàn 11,2 gam Fe vào dung dịch hydrochloric acid. khí hydrogen sinh ra được dẫn qua bột copper (II) oxide (dư) nung nóng
a) viết PTHH
b) tính thể tích khí h2 sinh ra ở đkc
c) tính khối lượng copper thu được sau phản ứng
nFe = 11,2/56 = 0,2 (mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
Mol: 0,2 ---> 0,4 ---> 0,2 ---> 0,2
VH2 = 0,2 . 22,4 = 4,48 (l)
PTHH: CuO + H2 -> (to) Cu + H2O
Mol: 0,2 <--- 0,2 ---> 0,2
mCu = 0,2 . 64 = 12,8 (g)
Đúng 2
Bình luận (1)
\(a,PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(b,n_{Fe}=\dfrac{m}{M}=\dfrac{11,2}{56}=0,2mol\)
\(\Rightarrow n_{H_2}=0,2mol\Rightarrow V_{H_2}=n.22,4=4,48l\)
\(\Rightarrow n_{FeCl_2}=0,2mol\)
\(c,m_{FeCl_2}=n.M=0,2.92,5=18,5g\)
Đúng 0
Bình luận (1)
Khử 12g copper(II)oxide (CuO) trong không khí H2(phản ứng xảy ra hoàn toàn)
A)viết pthh
B)tính khối lượng các sản phẩm tạo thành
C)tính thể tính khí H2(đkc)
Cu=64; O=16; H=1
a, PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Cu}=n_{H_2O}=n_{CuO}=0,15\left(mol\right)\)
b, \(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{H_2O}=0,15.18=2,7\left(g\right)\)
c, \(V_{H_2}=0,15.24,79=3,7185\left(l\right)\)
Đúng 2
Bình luận (0)
Đốt cháy 9,6g copper trong khí oxygen thu được 12g copper (II) oxide CuO.
Lập phương trình hóa học của phản ứng.
Bài 9: Cho 4 gam Copper (II) oxide CuO tác dụng với 100ml dung dịch Hydrochloric acid HCL a) Tính nồng độ mol dung dịch Hydrochloric acid HCl đã dùng. b) Tính khối lượng muối tạo thành. c. Tính nồng độ mol dung dịch muối thu được. Biết sau phản ứng thể tích dung dịch thay đổi không đáng kể Câu 10: Cho 3,6 g FeO tác dụng hết với dung dịch HCl 10%. Tínnh khối lượng dung dịch HCl đã dùng. Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
Đọc tiếp
Bài 9: Cho 4 gam Copper (II) oxide CuO tác dụng với 100ml dung dịch Hydrochloric acid HCL a) Tính nồng độ mol dung dịch Hydrochloric acid HCl đã dùng. b) Tính khối lượng muối tạo thành. c. Tính nồng độ mol dung dịch muối thu được. Biết sau phản ứng thể tích dung dịch thay đổi không đáng kể
Câu 10: Cho 3,6 g FeO tác dụng hết với dung dịch HCl 10%. Tínnh khối lượng dung dịch HCl đã dùng. Tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng.
Bài 9 :
\(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
0,05--->0,1-------->0,05
a) \(C_{MddHCl}=\dfrac{0,1}{0,1}=1\left(M\right)\)
b) \(m_{CuCl2}=0,05.135=6,75\left(g\right)\)
c) \(C_{MCuCl2}=\dfrac{0,05}{0,1}0,5\left(M\right)\)
Đúng 2
Bình luận (0)
Câu 10 :
\(n_{FeO}=\dfrac{3,6}{72}=0,05\left(mol\right)\)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
0,05-->0,1------->0,05
\(m_{ddHCl}=\dfrac{0,1.36,5}{10\%}100\%=36,5\left(g\right)\)
\(m_{ddspu}=3,6+36,5=40,1\left(g\right)\)
\(C\%_{FeCl2}=\dfrac{0,05.127}{40,1}.100\%=15,84\%\)
Đúng 2
Bình luận (0)
Câu 10 :
\(n_{FeO}=\dfrac{3,6}{72}=0,05\left(mol\right)\)
PTHH :
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
0,05 0,1 0,05 0,05
\(m_{ddHCl}=\dfrac{0,1.36,5.100}{10}=36,5\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{0,05.127}{\left(3,6+36,5\right)}.100\%=15,84\%\)
Đúng 0
Bình luận (1)
Viết PTHH biểu diễn các thí nghiệm sau:
a.nhiệt phân KClO3 với xúc tác MnO2 để điều chế khí oxygen
b.oxygen hóa iron
c.khí hydrogen khử copper(II) oxide CuO ở 400 độ C
d.hòa tan CaO vào nước
\(2KClO_3\xrightarrow[xtMnO_2]{t^o}2KCl+3O_2\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\
H_2+CuO\underrightarrow{400^oC}H_2O+Cu\\
CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Đúng 3
Bình luận (0)