Cho 6,5 gam kẽm tác dụng với axit HCl, sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu lít khí H2 ở đktc ?

Những câu hỏi liên quan
Cho 5,6 gam sắt tác dụng với axit HCl, sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu lít khí H2 ở đktc ?
Fe+2HCl->FeCl2+H2
0,1--------------------0,1 mol
n Fe= 0,1 mol
=>VH2=0,1.22,4=2,24l
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH:
`Fe + 2HCl -> FeCl_2 + H_2`
0,1------------------------>0,1
`=> V_{H_2} = 0,1.22,4 = 2,24 (l)`
Đúng 0
Bình luận (0)
Cho 3,6 gam magie phản ứng hoàn toàn với dung dịch axit sunfuric loãng (H2SO4) a.Viết phương trình phản ứng xảy ra và tính thể tích hidro thu được ở đktc. b. Cho lượng khí H2 thu được tác dụng hết với CuO. Hỏi sau phản ứng thu được bao nhiêu gam Cu?
Đọc tiếp
Cho 3,6 gam magie phản ứng hoàn toàn với dung dịch axit sunfuric loãng (H2SO4)
a.Viết phương trình phản ứng xảy ra và tính thể tích hidro thu được ở đktc.
b. Cho lượng khí H2 thu được tác dụng hết với CuO. Hỏi sau phản ứng thu được bao nhiêu gam Cu?
a)
\(Mg + H_2SO_4 \to MgSO_4 + H_2\\ n_{H_2} = n_{Mg} = \dfrac{3,6}{24} = 0,15(mol)\\ b)\\ CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ n_{Cu} = n_{H_2} = 0,15(mol)\\ \Rightarrow m_{Cu} = 0,15.64 = 9,6(gam)\)
Đúng 4
Bình luận (0)
a, Theo gt ta có: $n_{Mg}=0,15(mol)$
$Mg+H_2SO_4\rightarrow MgSO_4+H_2$
Ta có: $n_{H_2}=n_{Mg}=0,15(mol)\Rightarrow V_{H_2}=3,36(l)$
b, $CuO+H_2\rightarrow Cu+H_2O$
Do đó $n_{Cu}=0,15(mol)\Rightarrow m_{Cu}=9,6(g)$
Đúng 2
Bình luận (0)
a. PTPƯ: Mg + \(H_2SO_4\) ---> \(MgSO_4\) + \(H_2\) (Lập và cân bằng phương trình)
0,15 mol 0,15 mol 0,15 mol 0,15 mol
+ Số mol của Mg:
\(n_{Mg}\) = \(\dfrac{m}{M}\) = \(\dfrac{3,6}{24}\) = 0,15 (mol)
+ Thể tích của \(H_2\)
\(V_{H_2}\) = n . 22,4 = 0,15 . 22,4 = 3,36 (lít)
b. CuO + \(H_2\) ---> Cu + \(H_2O\) (Lập một phương trình mới)
0,3 mol 0,3 mol 0,1 mol 0,3 mol
+ Số g sau phản ứng của Cu:
\(m_{Cu}\) = n . M = 0,3 . 64 = 19,2 (g)
________________________________
Có gì không đúng thì nhắn mình nha bạn :))
Đúng 1
Bình luận (1)
Cho 6,5 gam kẽm tác dụng với HCl sau khi phản ứng kết thúc thu được ZnCl2 và khí H2
a) Tính khối lượng ZnCl2 trong dung dịch sau phản ứng
b) Tính thể tích khí Hidro thu được (đo ở đktc)
c) Với luowngk khí H2 trên có thể khử được bao nhiêu gam CuO
a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1-------------->0,1------>0,1
\(\Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\)
b) \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c) \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,1<---0,1
\(\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)
Đúng 1
Bình luận (0)
a: Zn+2HCl->ZnCl2+H2
0,2 0,4 0,2 0,2
mZnCl2=0,2*136=27,2(g)
b: V=0,2*22,4=4,48(lít)
Đúng 0
Bình luận (0)
Cho 6,4 gam Cu và 5,6 gam Fe tác dụng với lượng dư dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là A. 5,6 lít B. 4,48 lit C. 2,24 lít D. 3,36 lít
Đọc tiếp
Cho 6,4 gam Cu và 5,6 gam Fe tác dụng với lượng dư dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
A. 5,6 lít
B. 4,48 lit
C. 2,24 lít
D. 3,36 lít
Cho 6,4 gam Cu và 5,6 gam Fe tác dụng với lượng dư dung dịch HCl. Sau khi phản ứng xảy ra hoàn toàn, thu được V lít khí H2 (đktc). Giá trị của V là
A. 5,6 lít.
B. 2,24 lít.
C. 4,48 lit.
D. 3,36 lít.
Hòa tan hoàn toàn 6,5 gam kim loại kẽm bằng 1 lượng vừa đủ dung dịch axit clohidric (HCl), sau phản ứng thu được khí Hidro và muối kẽm clorua (ZnCl2).
a) Viết phương trình hóa học xảy ra?
b) Tính thể tích khí hidro thu được sau phản ứng ở đktc?
c) Tính khối lượng HCl đã phản ứng?
a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
Đúng 4
Bình luận (0)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)
Đúng 2
Bình luận (0)
: Khử hoàn toàn 12,8 gam Fe2O3 bằng khí hiđro ở nhiệt độ cao. a. Tính thể tích hiđro cần dùng ở đktc?b. Tính khối lượng Fe thu được sau phản ứng?c. Nếu đem toàn bộ lượng Fe thu được ở trên tác dụng với 14,6 gam axit HCl thì thu được bao nhiêu lít H2 (đktc)?
Đọc tiếp
: Khử hoàn toàn 12,8 gam Fe2O3 bằng khí hiđro ở nhiệt độ cao.
a. Tính thể tích hiđro cần dùng ở đktc?
b. Tính khối lượng Fe thu được sau phản ứng?
c. Nếu đem toàn bộ lượng Fe thu được ở trên tác dụng với 14,6 gam axit HCl thì thu được bao nhiêu lít H2 (đktc)?
Để giải bài toán này, ta cần biết phương trình phản ứng giữa oxit sắt (Fe2O3) và khí hidro (H2):
Fe2O3 + 3H2 → 2Fe + 3H2O
Theo đó, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.
a) Thể tích khí hiđro cần dùng:
Ta cần tìm số mol khí hidro cần dùng để khử hoàn toàn 12,8 gam Fe2O3.Khối lượng mol của Fe2O3 là:M(Fe2O3) = 2x56 + 3x16 = 160 (g/mol)
Số mol Fe2O3 là:n(Fe2O3) = m/M = 12.8/160 = 0.08 (mol)
Theo phương trình phản ứng, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.Vậy số mol H2 cần dùng là:n(H2) = 3*n(Fe2O3) = 0.24 (mol)
Thể tích khí hidro cần dùng ở đktc là:V(H2) = n(H2)22.4 = 0.2422.4 = 5.376 (lít)
Vậy thể tích khí hiđro cần dùng ở đktc là 5.376 lít.
b) Khối lượng Fe thu được sau phản ứng:
Theo phương trình phản ứng, mỗi mol Fe2O3 tạo ra 2 mol Fe.Vậy số mol Fe thu được là:n(Fe) = 2*n(Fe2O3) = 0.16 (mol)
Khối lượng Fe thu được là:m(Fe) = n(Fe)M(Fe) = 0.1656 = 8.96 (gam)
Vậy khối lượng Fe thu được sau phản ứng là 8.96 gam.
c) Thể tích khí hiđro thu được khi Fe tác dụng với HCl:
Ta cần tìm số mol H2 thu được khi Fe tác dụng với HCl.Theo phương trình phản ứng, mỗi mol Fe tác dụng với 2 mol HCl để tạo ra H2 và muối sắt (FeCl2).Số mol HCl cần dùng để tác dụng với Fe là:n(HCl) = m(HCl)/M(HCl) = 14.6/36.5 = 0.4 (mol)
Vậy số mol H2 thu được là:n(H2) = 2n(Fe) = 2(m(Fe)/M(Fe)) = 2*(8.96/56) = 0.16 (mol)
Thể tích khí hiđro thu được ở đktc là:V(H2) = n(H2)22.4 = 0.1622.4 = 3.584 (lít)
Vậy thể tích khí hiđro thu được ở đktc là 3.584 lít.

Đúng 0
Bình luận (0)
Hỗn hợp X gồm isobutilen, xiclohexan, axit acrylic và ancol butylic. Đốt cháy hoàn toàn m gam X cần vừa đủ 0,33 mol O2 thu được 5,376 lít (đktc) khí CO2 và 4,32 gam H2O. Khi lấy m gam X đem tác dụng với Na dư, sau khi các phản ứng xảy ra hoàn toàn thu được V lít (đktc) khí H2. Giá trị của V là A. 0,224. B. 0,336. C. 0,448. D. 0,560
Đọc tiếp
Hỗn hợp X gồm isobutilen, xiclohexan, axit acrylic và ancol butylic. Đốt cháy hoàn toàn m gam X cần vừa đủ 0,33 mol O2 thu được 5,376 lít (đktc) khí CO2 và 4,32 gam H2O. Khi lấy m gam X đem tác dụng với Na dư, sau khi các phản ứng xảy ra hoàn toàn thu được V lít (đktc) khí H2. Giá trị của V là
A. 0,224.
B. 0,336.
C. 0,448.
D. 0,560
Đáp án C
n C O 2 = 5 , 376 22 , 4 = 0 , 24 ( m o l ) n H 2 O = 4 , 32 18 = 0 , 24 ( m o l )
vì đốt cháy isobutilen, xiclohexan cho nH2O = nCO2; đốt cháy axit acrylic cho nCO2 > nH2O ; đốt cháy ancol butylic cho nCO2 < nH2O
Mà ta thấy nH2O = nCO2 => nCH2=CH-COOH = nC4H10O
Đặt nCH2=CH-COOH = nC4H10O = a (mol)
BTNT O: 2a + a + 0,33.2 = 0,24.2 +0,24
=> a = 0,02 (mol)
Khi tác dụng với Na chỉ có CH2=CH-COOH và C4H10O phản ứng
=> nH2 = ½ nH(linh động) = 1 2 ( nCH2=CH-COOH + nC4H10O) = 1 2 ( 0,02+ 0,02) = 0,02 (mol)
=> VH2 = 0,02.22,4 = 0,448 (lít)
Đúng 0
Bình luận (0)
Hỗn hợp X gồm isobutilen, xiclohexan, axit acrylic và ancol butylic. Đốt cháy hoàn toàn m gam X cần vừa đủ 0,33 mol O2 thu được 5,376 lít (đktc) khí CO2 và 4,32 gam H2O. Khi lấy m gam X đem tác dụng với Na dư, sau khi các phản ứng xảy ra hoàn toàn thu được V lít (đktc) khí H2. Giá trị của V là A. 0,224. B. 0,336. C. 0,448. D. 0,560.
Đọc tiếp
Hỗn hợp X gồm isobutilen, xiclohexan, axit acrylic và ancol butylic. Đốt cháy hoàn toàn m gam X cần vừa đủ 0,33 mol O2 thu được 5,376 lít (đktc) khí CO2 và 4,32 gam H2O. Khi lấy m gam X đem tác dụng với Na dư, sau khi các phản ứng xảy ra hoàn toàn thu được V lít (đktc) khí H2. Giá trị của V là
A. 0,224.
B. 0,336.
C. 0,448.
D. 0,560.
Đáp án C
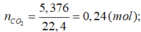
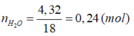
vì đốt cháy isobutilen, xiclohexan cho nH2O = nCO2; đốt cháy axit acrylic cho nCO2 > nH2O ; đốt cháy ancol butylic cho nCO2 < nH2O
Mà ta thấy nH2O = nCO2 => nCH2=CH-COOH = nC4H10O
Đặt nCH2=CH-COOH = nC4H10O = a (mol)
BTNT O: 2a + a + 0,33.2 = 0,24.2 +0,24
=> a = 0,02 (mol)
Khi tác dụng với Na chỉ có CH2=CH-COOH và C4H10O phản ứng
=> nH2 = 1 2 nH(linh động) = 1 2 ( nCH2=CH-COOH + nC4H10O) = 1 2 ( 0,02+ 0,02) = 0,02 (mol)
=> VH2 = 0,02.22,4 = 0,448 (lít)
Đúng 0
Bình luận (0)





















