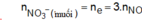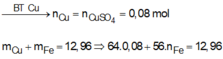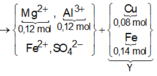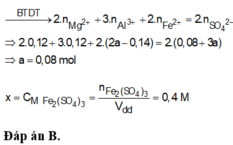hòa tan a gam hhX (K2O và CuO) vào nước đc 200ml ddA 0,4M và 4g chất rắn B.Tính giá trị của a

Những câu hỏi liên quan
Hòa tan a g hh X ( Na2O và MgO) vào nước được 200ml dd A 0,4M và 2,9 g chất rắn B. Tính giá trị của a
Na2O+H2O->2NaOH
0,04----------------0,08
n NaOH=0,08 mol
=>a=0,04.62+2,9=5,38g
Đúng 3
Bình luận (0)
hòa tan m gam hỗn hợp na2o và cuo vào nước thu đc 200 ml dd 0,4m và 4 gam chất rắn k tan.tính m
PTHH :
\(Na_2O+H_2O\rightarrow2NaOH\)
0,04 0,08
\(n_{NaOH}=0,2.0,4=0,08\left(mol\right)\)
\(m_{Na_2O}=0,04.62=2,48\left(g\right)\)
Do CuO ko tác dụng với H2O nên 4gam chất rắn = KL CuO
Ta có :
m = 2,48 + 4 = 6,48 (g)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 11 gam hỗn hợp kim loại gồm Na và Cu cần vừa đủ 2,24 lít O2 (đktc) thu được hỗn hợp chất rắn A gồm Na2O và CuO. Hòa tan hoàn toàn A vào 200ml nước thu được dung dịch B và chất rắn không tan C.a) Viết phương trình phản ứng và tính khối lượng mỗi chất ban đầu.b) tính nồng độ mol/l và nồng độ phần trăm của chất tan có trong dung dịch B.( Coi thể tích dung dịch không thay đổi không đáng kể trong quá trình thí nghiệm, DH2O 1g/ml)
Đọc tiếp
đốt cháy hoàn toàn 11 gam hỗn hợp kim loại gồm Na và Cu cần vừa đủ 2,24 lít O2 (đktc) thu được hỗn hợp chất rắn A gồm Na2O và CuO. Hòa tan hoàn toàn A vào 200ml nước thu được dung dịch B và chất rắn không tan C.
a) Viết phương trình phản ứng và tính khối lượng mỗi chất ban đầu.
b) tính nồng độ mol/l và nồng độ phần trăm của chất tan có trong dung dịch B.( Coi thể tích dung dịch không thay đổi không đáng kể trong quá trình thí nghiệm, DH2O= 1g/ml)
hòa tan hết 17.2 g hh X gồm Fe và 1 oxit sắt vào 200 gam dd HCl 14.6% thu đc ddA và 2.24 lít H2 đktc. thêm 33 g nước vào dd A được dd B .Nồng độ % của HCl trong HCl trong dd B là 2.92% .Mặt khác, cũng hòa tan hết 17.2 g hhX vào dd H2SO4 đặc nóng thì thu được V lít khí SO2 duy nhất đktc
1. x đ CTHH của oxit sắt
2. Tính khoảng giá trị của V
hòa tan 60 gam hhX gồm(Mg,Al,Fe,Cu)vào 0,8l dd H2SO4 4M thu đc 13,44l khí SO2,a gam S và dd Y chứa m muối tan
a,giá trị của a
b,giá trị gần nhất với m
Ta có: \(n_{H_2SO_4}=0,8.4=3,2\left(mol\right)\)
\(n_{SO_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(2H_2SO_4+2e\rightarrow SO_4^{2-}+SO_2+2H_2O\)
____1,2__________0,6_____0,6 (mol)
\(4H_2SO_4+6e\rightarrow3SO_4^{2-}+S+4H_2O\)
___2______________1,5___0,5 (mol)
a, mS = 0,5.32 = 16 (g) = a
b, m muối = mX + mSO42- = 60 + (0,6 + 1,5).96 = 261,6 (g)
Đúng 3
Bình luận (0)
Cho 6,72 lít clo (đktc) tác dụng với 14 gam Fe nung nóng (hiệu suất phản ứng 100%), sau pư thu đc chất rắn X. Hòa tan toàn bộ chất rắn X vào nước, khuấy đều, X tan hết và thu đc dd Y. Cô cạn dung dịch Y thu đc m(g) muối. Giá trị của m
A. 53,3 gam.
B. 35,5 gam.
C. 35,3 gam.
D. 32,5 gam.
\(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\\ n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ Vì:\dfrac{0,3}{3}< \dfrac{0,25}{2}\Rightarrow Fedư\\ n_{FeCl_3}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ m_{FeCl_3}=162,5.0,2=32,5\left(g\right)\\ \Rightarrow D\)
Đúng 0
Bình luận (0)
Cho 200ml dd NaOH nồng độ 3M vào phản ứng vừa đủ với 300 ml dd FeCl3 thu được dd A và kết tử B. a/ viết PTHH, tính CM ddA b/ lọc lấy kết tủa B nung đến khối lượng không đổi thu được a gam chất rắn. Tính giá trị của a
\(3NaOH+FeCl_3\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(n_{NaCl}=n_{NaOH}=0,2.3=0,6\left(mol\right)\)
=> \(C_{M\left(NaCl\right)}=\dfrac{0,6}{0,2}=3M\)
\(n_{Fe\left(ỌH\right)_3}=\dfrac{1}{3}n_{NaOH}=0,2\left(mol\right)\)
\(2Fe\left(OH\right)_3-^{t^o}\rightarrow Fe_2O_3+3H_2O\)
Ta có \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_3}=0,1\left(mol\right)\)
=> m Fe2O3 = 0,1 . 160=16(g)
Đúng 3
Bình luận (0)
hòa tan hết m gam na vào 200ml dung dịch h2so4 am. kết thúc phản ứng thu được 1,568 lít H2, khi cô cạn thu được 8,7g chất rắn. giá trị của a là
2Na+H2SO4\(\rightarrow\)Na2SO4+H2
2Na+2H2O\(\rightarrow\)2NaOH+H2
\(n_{H_2}=\dfrac{1,568}{22,4}=0,07mol\)
Chất rắn gồm Na2SO4 và NaOH
Gọi số mol Na tham gia ở mỗi phản ứng là x và y
x+y=0,07.2=0,14
142x/2+40y=8,7
Giải ra x=0,1 và y=0,04
Số mol H2SO4(PU 1)=x/2=0,05mol
a=\(\dfrac{0,05}{0,2}=0,25M\)
Đúng 0
Bình luận (0)
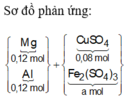
Cho 6,12 gam hỗn hợp Mg và Al có tỷ lệ mol 1:1 vào 200ml dung dịch CuSO4 0,4M và Fe2(SO4)3 Xm. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và hỗn hợp rắn Y gồm hai kim loại. Hòa tan hết rắn Y trong dung dịch HNO3 loãng, thu được dung dịch chứa 42,72 gam muối và 0,16 mol khí NO (sản phẩm khử duy nhất của N+5). Giá trị của x là: A.0,6. B. 0,4. C. 0,8. D. 0,3.
Đọc tiếp
Cho 6,12 gam hỗn hợp Mg và Al có tỷ lệ mol 1:1 vào 200ml dung dịch CuSO4 0,4M và Fe2(SO4)3 Xm. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch X và hỗn hợp rắn Y gồm hai kim loại. Hòa tan hết rắn Y trong dung dịch HNO3 loãng, thu được dung dịch chứa 42,72 gam muối và 0,16 mol khí NO (sản phẩm khử duy nhất của N+5). Giá trị của x là:
A.0,6.
B. 0,4.
C. 0,8.
D. 0,3.