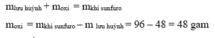Đốt 1,6gam lưu huỳnh cần 9,6 gam khí oxi
A.viết PTHH,sau phản ứng chất nào còn dư?khối lượng là bao nhiêu?
B.tính khối lượng SO2 sinh ra
đốt 1,6 gam lưu huỳnh cần 9,6 gam khí oxi. A) viết pthh sau phản ứng chất nào cònn dư? khối luợng là bao nhiêu. B) tính khối luợng so2 sinh ra
nS = 1,6/32 = 0,05 (mol)
nO2 = 9,6/32 = 0,3 (mol)
PTHH: S + O2 -> (t°) SO2
LTL: 0,05 < 0,3 => O2 dư
nSO2 = nS = 0,05 (mol)
mSO2 = 0,05 . 64 = 3,2 (g)
Câu 1: Đốt cháy 3,2g lưu huỳnh với 6g oxi thu được lưu huỳnh điôxit)
a) Lập PTHH của phản ứng trên
b) Sau phản ứng hóa học chất nào còn dư và khối lượng bao nhiêu gam
c)Tính khối lượng sản phẩm tạo thành
Câu 2: Đốt cháy 6,2g photpho trong bình kín chứa đầy ooxxi có thể tích 18,44 lít (đktc) ooxxi chiếm 1/5 thể tích không khí
a) Viết PTHH và tính khối lượng chất dư sau phản ứng
b) Tính khối lượng sản phẩm tạo thành
Bài 4: Đốt cháy hoàn toàn 6,4 gam Lưu huỳnh trong 6,72 lít khí Oxi (đktc).
a. Viết phương trình hóa học.
b. Sau phản ứng, chất nào còn dư? Dư bao nhiêu gam?
c. Tính khối lượng sản phẩm thu được sau phản ứng?
a, PTHH: S + O2 -> (t°) SO2
b, nS = 6,4/32 = 0,2 (mol)
nO2 = 6,72/22,4 = 0,3 (mol)
LTL: 0,2 < 0,3 => O2 dư
nO2 (pư) = nSO2 = nS = 0,2 (mol)
mO2 (dư) = (0,3 - 0,2) . 32 = 3,2 (g)
c, mSO2 = 64 . 0,2 = 12,8 (g)
a, \(S+O_2\underrightarrow{t^o}SO_2\)
\(nS=\dfrac{6,4}{32}=0,2\left(mol\right)\)
\(nO_2=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\dfrac{0,2}{1}< \dfrac{0,3}{1}\) => oxi dư
\(nO_{2\left(dư\right)}=0,1\left(mol\right)\)
\(mO_{2\left(dư\right)}=0,1.32=3,2\left(g\right)\)
\(nSO_2=nS=0,2\left(mol\right)\)
\(mSO_2=0,2.64=12,8\left(g\right)\)
S+O2--t-->SO2
nO2=6,72:22,4=0,3(mol)
nS=6,4: 32=0,2(mol)
Lập Tỉ Lệ : 0,2 < 0,4
=> O2 dư
theo pt , n S = nSO2 = 0,2 (mol)
=> mSO2 = n.M= 0,2. (32+16.2)=12,8 (g)
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
Theo giả thiết ta có: \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
\(S+O_2--t^o->SO_2\)
Ta có: \(n_{SO_2}=n_S=0,05\left(mol\right)\Rightarrow m_{SO_2}=0,05.64=3,2\left(g\right)\)
Đốt cháy 9,6 gam lưu Huỳnh trong bình khí oxi sinh ra lưu Huỳnh d(oxit ( SO2)
a, tính khối lượng M SO2?
b, VO2 (đkct)
a) \(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
PTHH: S + O2 ---to→ SO2
Mol: 0,3 0,3 0,3
\(m_{SO_2}=0,3.64=19,2\left(g\right)\)
b) \(V_{O_2}=0,3.22,4=6,72\left(l\right)\)
S + O2 → SO2
n S = 9,6:32 =0,3 = n O2 = n SO2
m SO2 = 0,3.(32+16.2)=19,2 g
V O2= 0,3.22,4=6,72 lít
\(a,\\n_S=9,6:32=0,3(mol)\\ S+O_2 \to SO_2\\ \)
\(n_{SO_2}=n_S=0,3 (mol)\\ \to m_{SO_2}=0,3.64=19,2(g)\)
\(b, n_{O_2}=0,3(mol)\\ V_{O_2}=0,3.22,4=6,72(l)\)
Đốt cháy 6,72 lít khí hiđro trong bình chứa 4,48 lít khí oxi.
a) Sau phản ứng, chất nào còn dư? Dư bao nhiêu gam?
b) Tính khối lượng sản phẩm thu được?
c) Tính khối lượng KMnO4 cần dùng để điều chế được lượng oxi dùng cho phản ứng trên?
(PTHH: KMnO4--->K2MnO4+MnO2+O2)
a, Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,05\left(mol\right)\Rightarrow m_{O_2\left(dư\right)}=0,05.32=1,6\left(g\right)\)
b, \(n_{H_2O}=n_{H_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,3.18=5,4\left(g\right)\)
c, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
_______0,3_______________________0,15 (mol)
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)
Bạn tham khảo nhé!
Bài 11: Đốt cháy 6,4 gam lưu huỳnh trong bình chứa 16 gam khí oxi tạo thành Lưu huỳnh đioxit
a) Lưu huỳnh hay oxi chất nào còn dư và số mol chất còn dư là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(n_{O_2}=\dfrac{16}{32}=0,5mol\)
\(S+O_2\underrightarrow{t^o}SO_2\)
0,2 0,5 0,2
Sau phản ứng oxi còn dư và dư \(0,5-0,2=0,3mol\)
Oxit axit được tạo thành là \(SO_2\) và có khối lượng:
\(m_{SO_2}=0,2\cdot64=12,8g\)
Đốt cháy 12,4g phốt pho trong 13,44 lít khí oxi ở đktc
a) viết PTHH xảy ra.
b)sau phản ứng chất nào còn dư? dư bao nhiêu gam hay lít?
c) khối lượng điphotpho pentaoxit thu được là bao nhiêu ?
4P + 5O2 -----to---> 2P2O5
0,4---0,5-----------> 0,2 (mol)
+ n P = 12,4 / 31 = 0,4 (mol)
+nO2 = 13,44 / 22,4 = 0,6 (mol)
Vì nP/4 = 0,1 < n O2 /5 = 0,12
=> Oxi còn thừa sau phản ứng .
mO2 dư = (0,6 - 0,5 ) . 32 = 3,2 (g)
b. chất tạo thành : P2O5
mP2O5 = 0,2 . ( 2.31 + 16 . 5 ) = 28,4 (g)
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\
n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\
pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\\
LTL:\dfrac{0,4}{4}< \dfrac{0,6}{5}\)
=> Oxi dư
\(n_{O_2\left(p\text{ư}\right)}=\dfrac{5}{4}n_P=0,5\left(mol\right)\\
m_{O_2\left(d\right)}=\left(0,6-0,5\right).32=3,2\left(g\right)\\
n_{P_2O_5}=\dfrac{1}{2}n_P=0,2\left(mol\right)\\
m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
Lưu huỳnh cháy theo sơ đồ phản ứng sau :
Lưu huỳnh + khí oxi → khí sunfuro
Nếu đốt cháy 48 gam lưu huỳnh và thu được 96 gam khí sunfuro thì khối lượng của oxi tham gia phản ứng là bao nhiêu?
Áp dụng định luật bảo toàn khối lượng, ta có :