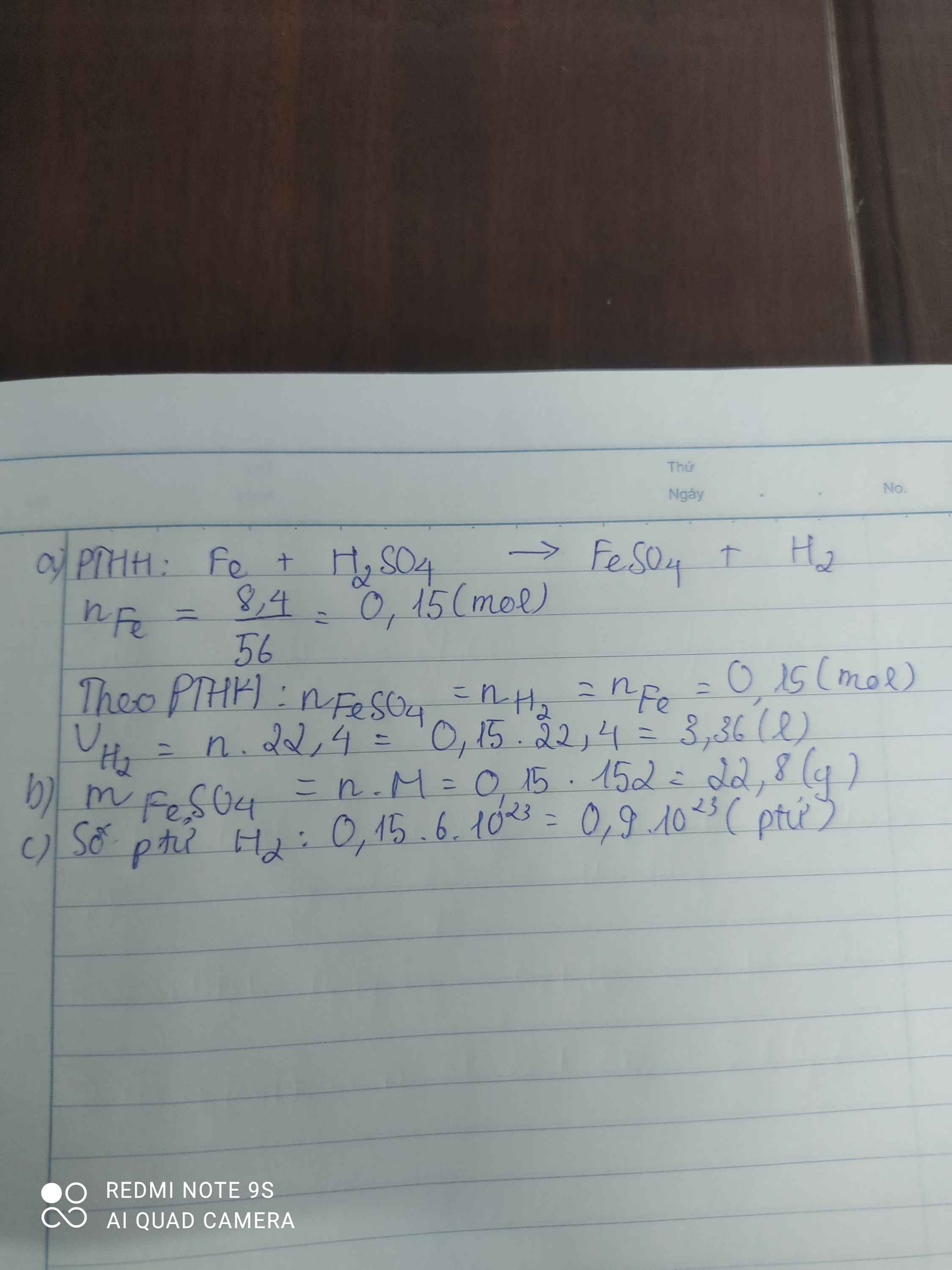cho a sắt phản ứng với H2SO4 loãng tạo thành FeSO4 và H2 sau phản ứng thu đc 3,36l khí H2 ở đktc

Những câu hỏi liên quan
Cho 5.6g fe tác dụng với 1.96g h2so4 loãng tạo thành muối feso4 và giải phóng h2 a) viết ptpư B) chất nào còn dư sau phản ứng ? Dư bao nhiêu g C)tính m muối tạo thành D tích thể tích khí h2 thu đc ở đktc
a) $Fe + H_2SO_4 \to FeSO_4 + H_2$
b) Ta thấy :
$n_{Fe} = \dfrac{5,6}{56} = 0,1 > n_{H_2SO_4} = \dfrac{1,96}{98} = 0,02$
Do đó Fe dư
$n_{Fe\ pư} = n_{H_2SO_4} = 0,02(mol)$
$m_{Fe\ dư} = 5,6 - 0,02.56 = 4,48(gam)$
c)
$n_{FeSO_4} = n_{H_2SO_4} = 0,02(mol) \Rightarrow m_{FeSO_4} = 0,02.152 = 3,04(gam)$
d)
$n_{H_2} = n_{H_2SO_4} = 0,02(mol)$
$V_{H_2} = 0,02.22,4 = 0,448(lít)$
Đúng 2
Bình luận (0)
nFe=5,6/56=0,1(mol)
nH2SO4=1,96/98=0,02(mol)
a) PTHH: Fe + H2SO4 -> FeSO4 + H2
b) Ta có: 0,02/1 < 0,1/1
=> Fe dư, H2SO4 hết => Tính theo nH2SO4.
=> nFe(p.ứ)=nFeSO4=nH2=nH2SO4=0,02(mol)
=>nFe(dư)=0,1 - 0,02=0,08(mol)
c) =>mFe(dư)= 0,08.56=4,48(g)
d) V(H2,đktc)=0,02.22,4=0,448(l)
Chúc em học tốt!
Đúng 1
Bình luận (0)
Cho 22,4 g sắt tác dụng với dung dịch axit sunfuric loãng theo sơ đồ phản ứng sau Fe + H2 SO4 ----> FeSO4 + H2 a. lập phương trình hóa học của phản ứng trên b. tính khối lượng muối FeSO4 thu được sau phản ứng ? c. tính thể tích khí H2 thu được ở đktc ? ( biết Fe=56; S=32; O=16;H=1 )
`a)`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,4` `0,4` `0,4` `(mol)`
`n_[Fe]=[22,4]/56=0,4(mol)`
`b)m_[FeSO_4]=0,4.152=60,8(g)`
`c)V_[H_2]=0,4.22,4=8,96(l)`
Đúng 3
Bình luận (0)
Fe + H2 SO4 ----> FeSO4 + H2
0,4----0,4-----------0,4-----------0,4
n Fe=0,4 mol
=>m FeSO4=0,4.152=60,8g
=>VH2=0,4.22,4=8,96l
Đúng 2
Bình luận (0)
Cho 11,2 g sắt vào 200 ml dung dịch H2SO4 2M tạo thành sắt II sunfat( FeSO4) và khí hiđrô.
a) Tính thể tích khí H2 tạo ra ở đktc?
b) Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu?
Fe+H2SO4->FeSO4+H2
0,2-----0,2-----0,2-------0,2
n Fe=0,2 mol
n H2SO4=0,4 mol
=H2SO4 dư
=>VH2=0,2.22,4=4,48l
=>m H2SO4 dư=0,2.98=19,6g
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 18g nhôm vào dung dịch H2SO4 loãng dưa. Tính thể tích H2 tạo thành ở điều kiện tiêu chuẩnb. Nếu dùng lượng H2 thu đc ở phản ứng trên cho phản ứng với 32g sắt 3 oxit đã đc nung nóng thì khối lượng sắt thu đc là bao nhiêuc. Tính thể tích không khí chứa 20% thể tích oxi ở điều kiện tiêu chuẩn cần dùng để phản ứng vừa đủ với lượng Sắt thu đc ở trên.Bt sản phẩm sau p.ứng là Sắt II.III oxit
Đọc tiếp
Hòa tan hoàn toàn 18g nhôm vào dung dịch H2SO4 loãng dư
a. Tính thể tích H2 tạo thành ở điều kiện tiêu chuẩn
b. Nếu dùng lượng H2 thu đc ở phản ứng trên cho phản ứng với 32g sắt 3 oxit đã đc nung nóng thì khối lượng sắt thu đc là bao nhiêu
c. Tính thể tích không khí chứa 20% thể tích oxi ở điều kiện tiêu chuẩn cần dùng để phản ứng vừa đủ với lượng Sắt thu đc ở trên.Bt sản phẩm sau p.ứng là Sắt II.III oxit
a)\(n_{Al}=\dfrac{18}{27}=\dfrac{2}{3}mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}\) 1
\(V_{H_2}=1\cdot22,4=22,4l\)
b)\(n_{Fe_2O_3}=\dfrac{32}{160}=0,2mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,2 1 0,4 0,6
\(m_{Fe}=0,4\cdot56=22,4g\)
c)\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,4 \(\dfrac{4}{15}\)
\(V_{O_2}=\dfrac{4}{16}\cdot22,4=\dfrac{448}{75}l\)
\(V_{kk}=5V_{O_2}=\dfrac{448}{15}l\approx29,87l\)
Đúng 3
Bình luận (0)
Cho 8,4gam sắt tác dụng với dung dịch axit sunfurie H2SO4 loãng, theo phương trình phàn ứng sau: Fe + H2SO4 ——> FeSO4 + H2 a) Tính thể tích khí hiđrô thoát ra ở đktc b) Tính khối lượng FeSO4 sinh ra c) Tính số phân tử khí hiđrô tạo thành
a.
n Fe=28562856=0,5 (mol)
Fe+H2SO4→FeSO4+H2↑
0,5→0,5 0,5 0,5 (mol)
b.
V H2(đktc)=0,5.22,4=11,2 (l)
c.
m HCl=0,5.36,5=18,25 (g)
d.
m FeSO4=0,5.152=76 (g)
Đúng 0
Bình luận (1)
Cho m gam Zn tác dụng với dung dịch H2SO4 loãng dư thu được V lít khí H2 đo ở đktc. Lượng khí H2 trên phản ứng vừa đủ với 16 gam sắt III oxit tạo ra kim loại và nước. Giá trị của m là:
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1---->0,3
Zn + H2SO4 --> ZnSO4 + H2
0,3<--------------------0,3
=> m = 0,3.65 = 19,5 (g)
Đúng 3
Bình luận (0)
a)
\(n_{Fe} = \dfrac{14}{56} = 0,25(mol)\)
Phương trình hóa học : \(Fe + H_2SO_4 \to FeSO_4 + H_2\)
Theo PTHH : \(n_{H_2} = n_{Fe} = 0,25(mol)\\ \Rightarrow V_{H_2} = 0,25.22,4 = 5,6(lít)\)
b)
Có : \(n_{H_2SO_4} = n_{H_2} = 0,25(mol)\\ \Rightarrow m_{H_2SO_4} = 0,25.98 = 24,5(gam)\)
Đúng 1
Bình luận (0)
cho sắt tác dụng với axit sunfuric loãng H2SO4: Fe + H2SO4 -> FeSO4 + H2. Nếu có 14g sắt tham gia phản ứng, em hãy tìm:a. thể tích khí hiđro thu được ở đktcb khối lượng Axit sunfuric cần dùng
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{H_2SO_4}=n_{Fe}=0,25\left(mol\right)\)
a, \(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
b, \(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
nFe = \(\dfrac{14}{56}\)= 0,25 mol
Fe + H2SO4 → FeSO4 + H2
Theo pt : 1 1 1 1 mol
Theo đề bài : 0,25 0,25 0,25 0,25 mol
=> V H2 = 0,25 . 22,4 = 5,6 lít
mH2SO4 = 0,25 . 98 = 24,5 gam
Đúng 1
Bình luận (0)
Cho 22,4g Fe tác dụng với dung dịch loãng có chứa 24,5 g H2SO4 sau phản ứng hãy cho biết: a, Chất nào dư sau phản ứng và dư bao nhiêu gam? b, Tính thể tích H2 thu được ở đktc. Có đc ghi fe +h2so4--->fe2(so4)3 +h2 đc ko ạ
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,25` `0,25` `0,25` `(mol)`
`a)n_[Fe]=[22,4]/56=0,4(mol)`
`n_[H_2 SO_4]=[24,5]/98=0,25(mol)`
Có: `[0,4]/1 > [0,25]/1=>Fe` hết, `H_2 SO_4`
`=>m_[Fe(dư)]=(0,4-0,25).56=8,4(g)`
`b)V_[H_2]=0,25.22,4=5,6(l)`
Ko được ghi `Fe+H_2 SO_4->Fe_2 (SO_4)_3+H_2` vì đây là `H_2 SO_4` loãng
Đúng 4
Bình luận (2)