Cho 13,7 gam Ba tan hết vào V ml dung dịch A l 2 S O 4 3 Sau khi các phản ứng kết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Giá trị của V gần nhất với giá trị nào sau đây
A. 260
B. 185
C. 355
D. 305
Cho 13,7 gam Ba tan hết vào V ml dung dịch Al2(SO4)3 0,1M. Sau khi các phản ứng kết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Giá trị của V gần nhất với giá trị nào sau đây?
A. 260
B. 185
C. 355
D. 305
Cho 13,7 gam Ba tan hết vào V ml dung dịch Al2(SO4)3 0,1M. Sau khi các phản ứng kết thúc thấy khối lượng dung dịch giảm 10,59 gam so với ban đầu. Giá trị của V gần nhất với giá trị nào sau đây?
A. 260
B. 185
C. 355
D. 305
Đáp án D
Định hướng tư duy giải
Ta có:
Câu 6. Hòa tan hoàn toàn 5,85 gam K và 13,7 gam Ba vào 400 ml H2O thu được dung dịch F, Tính nồng độ %, nồng độ mol/l của dung dịch F
hòa tan 13,7 g Ba vào 1 lít dd H2SO49,8%(D=1,25g/ml)
tính nồng độ % của dung dịch
đổi 1l = 1000ml
mddH2SO4 = 1000.1,25= 1250g
nBa=13,7/137=0,1mol
pt : Ba + H2SO4 -----> BaSO4 + H2
npứ 0,1 --->0,1
mH2SO4 = 0,1 . 98 = 9,8g
C%(H2SO4)=\(\dfrac{9,8}{1250}.100=0,784\%\)
\(n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\)
Vì Ba là kim loại mạnh có tính kiềm nên khi p/ứ với dd H2SO4, Ba sẽ p/ứ với nước có trong dd axit sau đó mới p/ứ với axit
\(PTHH:Ba+H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)(1)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+H_2O\) (2)
\(m_{ddH_2SO_4}=1000.1,25=1250\left(g\right)\)
\(\Rightarrow m_{H_2SO_4}=\dfrac{49,8.1250}{100}=622,5\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{622,5}{98}=\dfrac{1245}{196}\approx6,35\left(mol\right)\)
Theo PT (1) : \(n_{Ba\left(OH\right)_2}=n_{Ba}=0,1\left(mol\right)\)
Theo PT (2) Lập tỉ lệ ta thấy H2SO4 dư
Sau p/ứ dung dịch thu được là H2SO4 dư còn BaSO4 là kết tủa nên không phải là dung dịch
\(\Rightarrow n_{H_2SO_4du}=\dfrac{1245}{196}-0,1=\dfrac{6127}{980}\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=\dfrac{6127}{980}.98=612,7\left(g\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{612,7}{1250}.100=49,016\%\)
Hòa tan hết 4 gam SO3 vào nước dư được 200 ml dung dịch X chứa H2SO4 a mol/l. Trung hòa X cần dùng V ml dung dịch NaOH 0,25M. Tính a, V ?
\(n_{SO_3}=\dfrac{4}{80}=0,05\left(mol\right)\)
PTHH: SO3 + H2O ----> H2SO4
Mol: 0,05 0,25
\(a=C_{M_{H_2SO_4}}=\dfrac{0,25}{0,2}=1,25M\)
PTHH: H2SO4 + 2NaOH -----> Na2SO4 + 2H2O
Mol: 0,25 0,5
\(b=V_{ddNaOH}=\dfrac{0,5}{0,25}=2\left(l\right)=2000\left(ml\right)\)
Các bạn giúp mình 2 câu này với
Câu 2. Trộn 39,2gam dung dịch H2SO4nồng độ 25% vào 16gam dung dịch NaOH 30%. Tìm nồng độ % các chất tan trong dung dịch sau phản ứng.
Câu 3. Hòa tan 13,7 gam Ba trong 250ml H2O (D = 1,008 g/ml) thu được dung dịch X và khí Y (đktc)a) Tính C% của dung dịch X.b) Lấy 212,4 gam dung dịch X tác dụng với 14,7 gam dung dịch H2SO440% thu được dung dịch Z. Tìm C% các chất tan trong Z.
Câu 2:
\(m_{H_2SO_4}=39,2.25\%=9,8\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
\(m_{NaOH}=16.30\%=4,8\left(g\right)\Rightarrow n_{NaOH}=\dfrac{4,8}{40}=0,12\left(mol\right)\)
PTHH: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Mol: 0,06 0,12 0,06
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,12}{2}\) ⇒ H2SO4 dư, NaOH hết
mdd sau pứ = 39,2+16 = 55,2 (g)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,1-0,06\right).98.100\%}{55,2}=7,1\%\)
\(C\%_{ddNa_2SO_4}=\dfrac{0,06.142.100\%}{55,2}=15,43\%\)
Câu 3.
a)\(n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\)
PTHH: Ba + 2H2O → Ba(OH)2 + H2
Mol: 0,1 0,1 0,1
mdd sau pứ = 13,7+250.1,008-0,1.2 = 265,5 (g)
\(C\%_{ddBa\left(OH\right)_2}=\dfrac{0,1.171.100\%}{265,5}=6,44\%\)
Cho 13,7 gam Ba vào 100 ml dung dịch HCl 1M thu được dung dịch X. Cho dung dịch X vào 100 ml dung dịch FeSO4 0,7 M thu được kết tủa Y. Khối lượng kết tủa Y là
A. 16,31 gam
B. 25,31 gam
C. 20,81 gam
D. 14,50 gam
Chọn đáp án C.
Dung dịch X có nBaCl2 = 0,05, nBa(OH)2 = 0,05
=> n S O 4 2 - < nBa2+ và nFe2+ <nOH- => mRắn = 0,07 × 233 + 0,05 × 90 = 20,81 gam
Hòa tan hết 17,72 gam hỗn hợp X gồm Al2O3 và FeCO3 cần dùng vừa đủ 280 ml dung dịch H2SO4 1M, thu được dung dịch Y. Cho V ml dung dịch Ba(OH)2 1M vào dung dịch Y, thu được 77,36 gam kết tủa. Giá trị lớn nhất của V là:
A. 320
B. 240
C. 280
D. 260
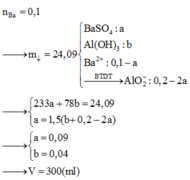
Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước thu được dung dịch Y và 13,44 lít H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y thu được m gam kết tủa. Lấy m gam kết tủa đó cho tan hết trong V mL dung dịch KOH 1,25M. Giá trị tối thiểu của V là
A. 240.
B. 360.
C. 320.
D. 220.
Đáp án A
%mO/X = 86,3×0,1947 = 16,8 gam.
⇒ nO = 1,05 ⇒ nAl2O3 = 0,35 mol.
Ta có ∑nOH– = 2nH2 = 1,2 mol.
⇒ Dung dịch Y chứa nAlO2– = nAl/Al2O3 = 0,7 mol || nOH dư = 0,5 mol.
+ Sau phản ứng trung hòa nH+ = 3,2×0,75 – 0,5 = 1,9 mol
⇒ nAl(OH)3 = 0,7 – 1 , 9 - 0 , 7 3 = 0,3 mol.
+ Cho 0,3 mol Al(OH)3 phản ứng với KOH ta có phản ứng:
Al(OH)3 + KOH → KAlO2 + 2H2O ||⇒ nKOHcần dùng = 0,3.
⇒ VKOH = 0 , 3 1 , 25 = 0,24 lít = 240 ml