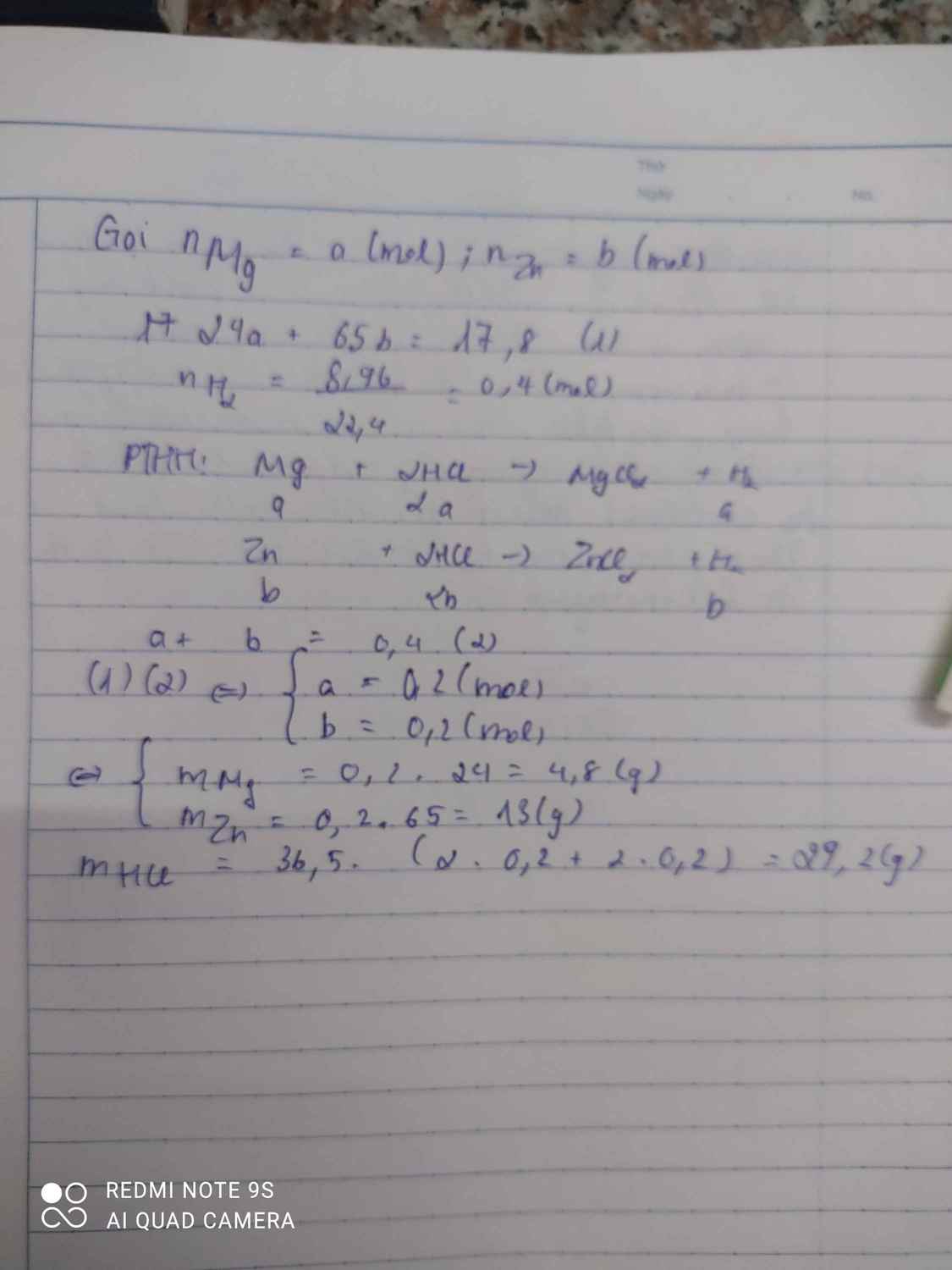bài 1:Cho m gam bột Al td vs O2 thu đc 12,9g hỗn hợp rắn X.Cho td vs lượng dư HCl thu đc 3,36l khí O2 ở đktc
a,Viết các PTHH
b, tính giá trị của m
c,Tính khối lượng oxi à HCl phản ứng
bài 2:Hỗn hợp X đốt cháy hoàn toàn 3,6g kim loại M trg bình chứa O2 thu đc 6g oxit A hoà tan hoàn toàn A trg dd HCl vừa đủ thu đc m gam muối
a, Xác định kim loại M
b,tính m
bài 3:cho 8,4g Fe tác dụng hết vs O2thu đc m gam oxit sắt từ
a,tính m
b cho 0,5m gam Fe2O3 tác dụng vs H2SO4 loãng .Tính khối lượng muối thu đc sau phản ứng
bài 4:đốt cháy 5g hỗn hợp C và S trg bình chứa O2 dư thu đc 13g hỗn hợp sản phẩm của CO2và SO2.Tính VO2 ở đktc đã phản ứng
bài 5:để đốt cháy hoàn toàn 6,72 lít hỗn hợp khí X gồm CO và H2 cần dùng v lít oxi vừa đủ
a,viết PTHH
b,tính v
bài 6:đốt 22,8g hỗn hợp CuS và FeS trg khí oxi dư thu đc m gam hỗn hợp chất rắn gồm Fe2O3 và CuO và 5,6 lít SO2 ở đktc
a,viết các PTHH
b, tính thành phần % khối lượng mỗi oxit trg hỗn hợp rắn
bài 7: đốt cháy hoàn toàn m gam rượu etylic=v lít khí oxi ở đktc (vừa đủ thu đc CO2 và 5,4g nước)
a,viết các PTHH xảy ra
b,tính m và v