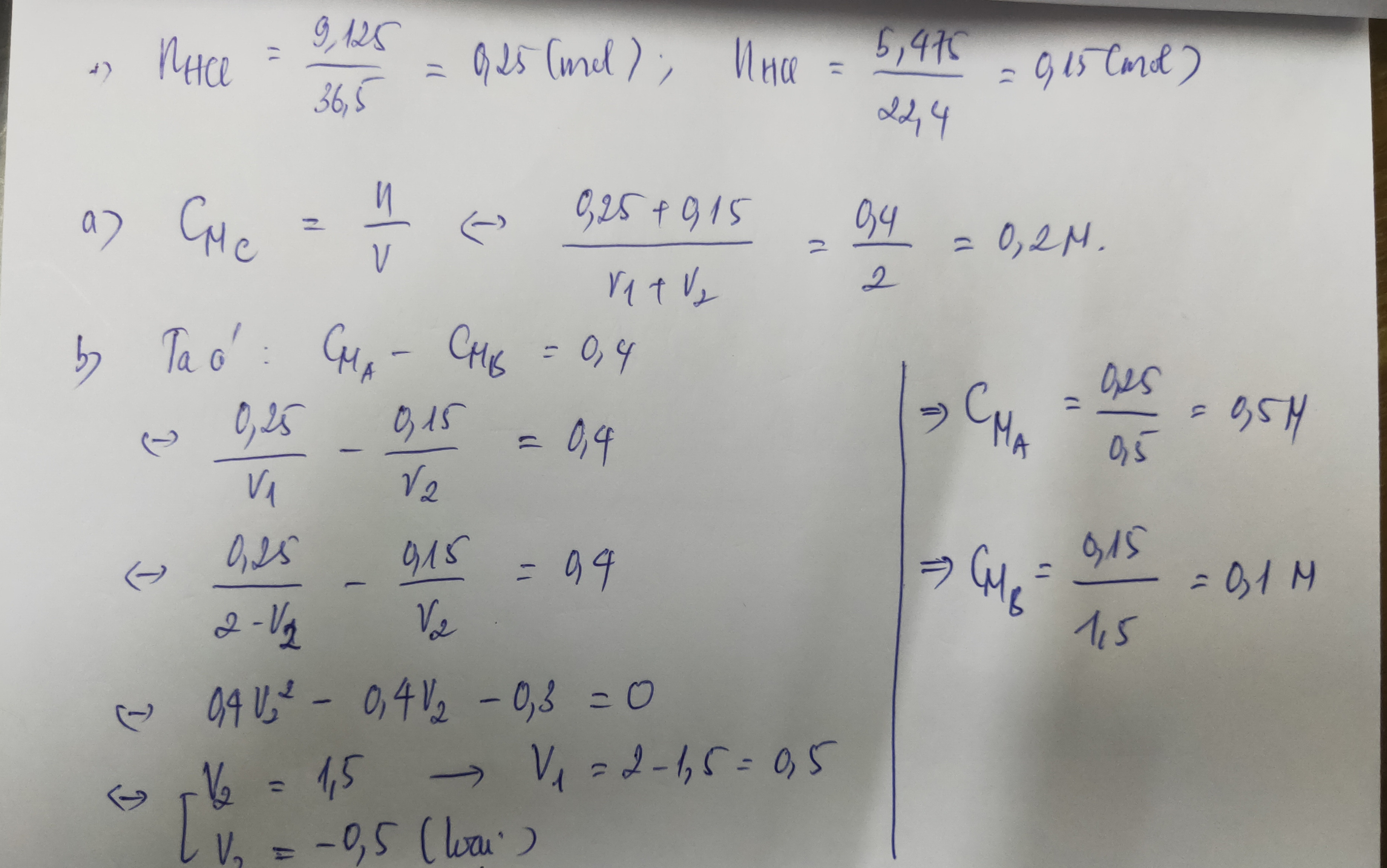Có 4 dd HCl ; H2SO4 ; HNO3 và Na2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.

Những câu hỏi liên quan
1.Có 2 dd HCl và H2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.2) Có 3 dd HCl ; H2SO4 và HNO3 đựng trong các lọ riêng biệt .Hãy phân biệt.3) Có 4 dd HCl ; H2SO4 ; HNO3 và Na2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.4) Có 4 dd HCl ; H2SO4 ; NaOH và Na2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.
Đọc tiếp
1.Có 2 dd HCl và H2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.
2) Có 3 dd HCl ; H2SO4 và HNO3 đựng trong các lọ riêng biệt .Hãy phân biệt.
3) Có 4 dd HCl ; H2SO4 ; HNO3 và Na2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.
4) Có 4 dd HCl ; H2SO4 ; NaOH và Na2SO4 đựng trong các lọ riêng biệt .Hãy phân biệt.
2) Trích mẫu thử :
Cho dung dịch BaCl2 vào 3 mẫu thử :
+ Chất nào xuất hiện kết tủa trắng không tan trong axit : H2SO4
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Không hiện tượng : HCl , HNO3
Cho dung dịch AgNO3 vào 2 mẫu thử còn :
+ Chất nào xuất hiện kết tủa trắng : HCl
Pt : \(AgNO_3+HCl\rightarrow AgCl+HNO_3\)
Còn lại : HNO3
Chúc bạn học tốt
Đúng 1
Bình luận (0)
4) Trích mẫu thử :
Cho quỳ tím vào từng mẫu thử :
+ Hóa đỏ : HCl , H2SO4
+ Hóa xanh : NaOH
+ Không đổi màu : Na2SO4
Cho dung dịch BaCl2 vào 2 mẫu thử làm quỳ tím hóa đỏ :
+ Chất nào xuất hiện kết tủa trắng không tan trong axit : H2SO4
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Không hiện tượng : HCl
Chúc bạn học tốt
Đúng 1
Bình luận (0)
1) Trích mẫu thử :
Cho dung dịch BaCl2 vào từng mẫu thử :
+ Chất nào xuất hiện kết tủa trắng không atn trong axit : H2SO4
Pt : \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Không hiện tượng : HCl
Chúc bạn học tốt
Đúng 0
Bình luận (0)
5) Có 4 dd HCl ; H2SO4 ; NaCl và Na2SO4 đựng trong các lọ riêng biệt. Hãy phân biệt.
6) Có 6 dd HCl ; H2SO4 ; NaCl và Na2SO4, HNO3, NaNO3 đựng trong các lọ riêng biệt. Hãy phân biệt.
7) Có 4 dd HCl ; H2SO4 ; NaOH và Ba(OH)2 đựng trong các lọ riêng biệt .Hãy phân biệt. Chỉ được dùng quỳ tím.
5) Có 4 dd HCl ; H2SO4 ; NaCl và Na2SO4 đựng trong các lọ riêng biệt. Hãy phân biệt.
6) Có 6 dd HCl ; H2SO4 ; NaCl và Na2SO4, HNO3, NaNO3 đựng trong các lọ riêng biệt. Hãy phân biệt.
7) Có 4 dd HCl ; H2SO4 ; NaOH và Ba(OH)2 đựng trong các lọ riêng biệt .Hãy phân biệt. Chỉ được dùng quỳ tím.
5)
Cho quỳ tím vào từng chất:
Quỳ tím chuyển đỏ: HCl, H2SO4 ( nhóm 1)
Quỳ tím không đổi màu: NaCl, Na2SO4 ( nhóm 2)
Cho dd Ba(OH)2 dư vào từng nhóm:
Nhóm 1: không hiện tượng là HCl
xuất hiện kết tủa là H2SO4
Ba(OH)2 + H2SO4 -----> BaSO4 + 2H2O
Nhóm 2: không hiện tượng là NaCl
xuất hiện kết tủa là Na2SO4
Ba(OH)2 + Na2SO4 ----> BaSO4 + 2NaOH
6)
Cho quỳ tím vào từng chất
Quỳ tím chuyển đỏ: HCl, H2SO4, HNO3 ( nhóm 1)
Quỳ tím không đổi màu: NaCl, Na2SO4, NaNO3 ( nhóm 2)
Cho dung dịch Ba(OH)2 dư vào nhóm 1:
Tạo kết tủa: H2SO4
Không hiện tượng: HCl, HNO3
Cho dd AgNO3 dư vào thì có kết tủa là: HCl
Còn lại là HNO3
Cho dung dịch Ba(OH)2 dư vào nhóm 2
Tạo kết tủa là Na2SO4
Không hiện tượng: NaCl, NaNO3
Cho dd AgNO3 dư vào thì có kết tủa là: NaCl
Còn lại là NaNO3
7)
Cho quỳ tím vào từng chất:
Quỳ tím chuyển đỏ: HCl, H2SO4 ( nhóm 1)
Quỳ tím chuyển xanh: NaOH, Ba(OH)2 ( nhóm 2)
Cho từng chất ở nhóm 1 tác dụng nhóm 2:
Nếu tạo kết tủa thì là Ba(OH)2 và H2SO4
Còn lại HCl và H2SO4
Phân thành từng nhóm nên khi biết được mỗi cái của từng nhóm là biết cái còn lại rồi
Đúng 1
Bình luận (0)
cho 10ml dd HCl có pH=3.Hãy đề nghị cách pha dd có pH=4 từ dd trên
Ta có: \(pH=-log\left[H^+\right]=3\Rightarrow\left[H^+\right]=10^{-3}\left(M\right)\)
\(\Rightarrow n_{HCl}=n_{H^+}=10^{-3}.0,01=10^{-5}\left(mol\right)\)
\(pH=4=-log\left[H^+\right]\) ⇒ [H+] sau pha = 10-4 (M) = [HCl] sau pha
⇒ VHCl sau pha = \(\dfrac{10^{-5}}{10^{-4}}=0,1\left(l\right)=100\left(ml\right)\)
→ Cần thêm 90 ml nước vào dd chứa 10 ml HCl pH = 3 để được dd có pH = 4
Đúng 2
Bình luận (0)
Pha loãng dd HCL có pH=3 bao nhiêu lần để được dd mới có pH=4?
\(\left[H+\right]\) ban đầu \(=10^{-3}=0,001\)
\(\left[H+\right]\) lúc sau \(=10^{-4}=0,0001\)
Ta có :
\(\left[H+\right]\) ban đầu \(\times\) \(V\) ban đầu = \(\left[H+\right]\) lúc sau \(\times\) \(V\) sau
\(\frac{Vsau}{Vđầu}=\frac{\left[H+\right]đầu}{\left[H+\right]sau}=\frac{0,001}{0,0001}=10\) lần
Đúng 0
Bình luận (0)
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH làVí dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằngVí dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH làVí dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H...
Đọc tiếp
Ví dụ 3: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M được 2V ml dung dịch Y. Dung dịch Y có pH là
Ví dụ 4: Trộn 20 ml dd HCl 0,05M với 20 ml dd H2SO4 0,075M thu được 40ml dd có pH bằng
Ví dụ 5: Trộn 20 ml dd KOH 0,35M với 80 ml dung dịch HCl 0,1 M được 100ml dd có pH là
Ví dụ 6: Cho 40ml dd HCl 0,75M vào 160ml dd chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M thu được 200ml dd có pH là
Ví dụ 7: Trộn 100ml dd hỗn hợp gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dd hỗn hợp gồm H2SO4 0,0375M và HCl 0,0125M thu được dd có pH là
Ví dụ 8: Trộn lẫn 2 dd có thể tích bằng nhau của dd HCl 0,2M và dd Ba(OH)2 0,2M. pH của dd thu được là
Ví dụ 9: Trộn hai thể tích dd HCl 0,1M với một thể tích dd gồm NaOH 0,2M và Ba(OH)2 0,15M thu được dd Z có pH là
Ví dụ 10: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 x mol/l thu được 500 ml dd có pH=2. Giá trị của x là
Ví dụ 11: Trộn 300 ml dd HCl 0,05 M với 200 ml dd Ba(OH)2 a mol/l thu được 500 ml dd có pH=12. Giá trị của a là
Ví dụ 12: Trộn 100 ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100 ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M, thu được dung dịch X. Dung dịch X có pH bằng
Ví dụ 13: Trung hòa 300 ml dung dịch hỗn hợp HCl và HNO3 có pH=2 cần V ml dung dịch NaOH 0,02M. Giá trị của V là
Ví dụ 14: Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4?
Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2
Đúng 3
Bình luận (0)
Ví dụ 3 :
n NaOH = 0,01.0,001V(mol)
n HCl = 0,03.0,001V(mol)
$HCl + NaOH \to NaCl + H_2O$
n HCl dư = 0,03.0,001V - 0,01.0,001V = 0,02.0,001V(mol)
Suy ra :
[H+ ] = CM HCl dư = 0,02.0,001V/0,002V = 0,01(M)
=> pH = -log(0,01) = 2
Đúng 4
Bình luận (0)
Ví dụ 4 :
n HCl = 0,02.0,05 = 0,001(mol)
n H2SO4 = 0,02.0,075 = 0,0015(mol)
=> n H+ = 0,001 + 0,0015.2 = 0,004(mol)
V dd = 0,02 + 0,02 = 0,04(ml)
=> [H+ ] = 0,004/0,04 = 0,1M
=> pH = - log(0,1) = 1
Đúng 4
Bình luận (0)
Có V1 lít dd HCl chứa 9,125g HCl (dd A) và V2 lít dd HCl chứa 6,475 HCl (dd B). Trộn dd A với ddB để được 2l ddC. Khi pha trộn V dd không đổi
a/ Tính CM của dd C
b/ Tính CM của 2 dd A và B biết hiệu số CM của 2 dd là 0,4M.
Có 4 kim loại X, Y, Z, T đứng sau Mg trong dãy hđ hóa học. Biết Z và T tan trong dd HCl, X và Y không tan trong dd HCl, Z đẩy được T trong dd muối T,X đẩy được Y trong dd muối Y, Thứ tự hđ hóa học tăng dần là :
- X và Y tác dụng với dung dịch HCl giải phóng khí hidro → X, Y đứng trước Hidro trong dãy hoạt động hóa học.
- Z và T không phản ứng với dung dịch HCl → Z, T đứng sau Hidro trong dãy hoạt động hóa học. → X, Y là kim loại mạnh hơn Z, T. - Y tác dụng với dung dịch muối của X và giải phóng X → Y là kim loại mạnh hơn X. - T tác dụng được với dung dịch muối của Z và giải phóng Z → T là kim loại mạnh hơn Z. → thứ tự sắp xếp các kim loại (theo chiều hoạt động hóa học giảm dần) là: Y, X, T, Z
Đúng 0
Bình luận (0)
Nêu hiện tượng, viết PTHH:
a) Cho dd HCl vào ống nghiệm chứa Fe 2 O 3
b) Ngâm đinh sắt vào dung dịch CuSO 4
c) Nhỏ dd BaCl 2 vào ống nghiệm chứa dd Na 2 SO 4
d/ Nhỏ dung dịch HCl vào ống nghiệm có chứa mẫu đá vôi
e/ Nhỏ vài giọt dd CuSO 4 vào ống nghiệm chứa dd NaOH
f/ Nung nóng Cu(OH) 2 trên ngọn lửa đèn cồn
a) \(HCl+Fe_2O_3\rightarrow FeCl_3+H_2O\)
b) \(Fe+CuCO_4\rightarrow Cu+FeSO_4\)
c) \(BaCl_2+Na_2SO_4\rightarrow2NaCl+BaSO_4\)
d) \(2HCl+CaCO_3\rightarrow CaCl_2+CO_2+H_2O\)
e) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
f) \(Cu\left(OH\right)_2\rightarrow CuO+H_2O\)
Đúng 0
Bình luận (2)
a) \(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
b) \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
c) \(BaCl_2+Na_2SO_4\rightarrow BaSO_4\downarrow+2NaCl\)
d) \(2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+H_2O\)
e) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
f) \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Đúng 0
Bình luận (0)
Bài 14: Tìm tỉ lệ thể tích của dd HCl 0,1M và dd HCl 0,35M để pha được dd HCl có nồng độ là 0,3M?
Áp dụng quy tắc đường chéo, ta có:
\(\dfrac{V_{HCl\left(0,1M\right)}}{V_{HCl\left(0,35M\right)}}=\dfrac{0,35-0,3}{0,3-0,1}=\dfrac{1}{4}\)
Đúng 2
Bình luận (0)