Câu 3: Cho m gam (sắt) Fe phản ứng với dd HCl dư thu được 0,336 lit khí H2(đktc) tính m.

Những câu hỏi liên quan
Cho m gam (sắt) Fe phản ứng với dd HCl dư thu được 0,336 lit khí H2 (đktc) tính m.
(đktc) tính m.
Thể tích khí H2: 

 Số mol
Số mol
Phương trình:
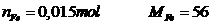


 khối lượng
khối lượng
Vậy m = 0,84gam
Đúng 0
Bình luận (0)
Cho m gam (sắt) Fe phản ứng với dd HCl dư thu được 0,336 lit khí H2 (đktc) tính m.
Fe+2HCl->FeCl2+H2
0,015-------------------0,015 mol
n H2=0,336\22,4=0,015 mol
=>m Fe=0,015.56=0,84g
Đúng 0
Bình luận (0)
PTHH
Fe + 2HCL --> Fecl2 +H2
TBR, ta có : nH2 = 0,336 / 22,4 = .............(mol) (tự tính)
Theo PTHH, nFe = nH2 = .........(tính trên kia)
=> m Fe = nFe . 56 = (g)
Đúng 0
Bình luận (0)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=n_{H_2}=\dfrac{0,336}{22,4}=0,015\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,015.56=0,84\left(g\right)\)
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 15,4g hỗn hợp A (Al và CaCO3) trong 300g dd HCl 14,6% sau phản ứng thu được 310,4g dd X và V lít(đktc) hỗn hợp khí Y
A/ Viết các phương trình phản ứng và tính V
B/ cho một nửa dd X tácdụng hết với dung dịch AgNO3 dư thu được m gam kết tủa. TÍnh m
Cho 13 gam Zn tác dụng hết với dd HCl.
a) Tính thể tích khí H2 thu được ở đktc
b) Dẫn khí H2 ở trên đi qua 24 gam CuO đun nóng. Tìm khối lượng Cu thu được.
c) Tính thể tích khí O2 (đktc) cần đủ phản ứng với lượng H2 ở trên..
Xem chi tiết
PTHH: Zn + 2 HCl -> ZnCl2 + H2
nZn=13/65=0,2(mol)
nH2=nZnCl2=nZn=0,2(mol)
a) V(H2,đktc)=0,2.22,4=4,48(l)
b) nCuO= 24/80=0,3(mol)
PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,3/1 > 0,2/1 => CuO dư, H2 hết, tính theo nH2
=> nCu=nH2=0,2(mol)
=> mCu=0,2.64=12,8(g)
c) 2 H2 + O2 -to-> H2O
nO2= 1/2 . nH2= 1/2 . 0,2=0,1(mol)
=> m(O2,đktc)=0,1.22,4=2,24(l)
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp X gồm Mg, Fe tác dụng với axit HNO3 đặc (dư). Sau phản ứng thu được 14,56 lít khí NO2 duy nhất (đktc). Cô cạn dung dịch sau phản ứng được 49,1 gam muối khan. Tính thánh phần % khối lượng của các kim loại trong hỗn hợp.
Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
Muối gồm :
$Mg(NO_3)_2 : a(mol)$
$Fe(NO_3)_3 : b(mol)$
$\Rightarrow 148a + 242b = 49,1(1)$
Bảo toàn electron : $2n_{Mg} + 3n_{Fe} = 2a + 3b = n_{NO_2} = 0,65(2)$
Từ (1)(2) suy ra a = 0,25 ; b = 0,05
$\%m_{Mg} = \dfrac{0,25.24}{0,25.24 + 0,05.56}.100\% = 68,18\%$
$\%m_{Fe} = 100\% -68,18\% = 31,82\%$
Đúng 0
Bình luận (0)
Cho 7,02g hỗn hợp Al và Ag tác dụng với dung dịch HNO3 loãng thu được 0,896 lít khí NO (đtc)( sản phẩm khử duy nhất) . Tính% khối lượng mỗi kim loại có trong hỗn hợp
Đúng 0
Bình luận (0)
cho 2,8g bột sắt td với 150ml Hcl 2M sau phản ứng thu được dd X và V lít khí hidro. thêm dd naoh đến dư vào dd Xthu được m gam kết tủa Y. a dd X gồm những chất nào viết ptpu b tính V c tính m
a. PTHH:
Fe + 2HCl ---> FeCl2 + H2 (1)
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(n_{HCl}=\dfrac{150}{1000}.2=0,3\left(mol\right)\)
Ta thấy: \(\dfrac{0,05}{1}< \dfrac{0,3}{2}\)
Vậy HCl dư.
Vậy trong X chứa FeCl2 và HCl dư.
b. PTHH:
2NaOH + FeCl2 ---> Fe(OH)2 + 2NaCl (2)
HCl + NaOH ---> NaCl + H2O (3)
Theo PT(1): \(n_{H_2}=n_{Fe}=0,05\left(mol\right)\)
=> \(V_{H_2}=0,05.22,4=1,12\left(lít\right)\)
c. Theo PT(1): \(n_{FeCl_2}=n_{Fe}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Fe\left(OH\right)_2}=n_{FeCl_2}=0,05\left(mol\right)\)
=> \(m_{Fe\left(OH\right)_2}=0,05.90=4,5\left(g\right)\)
Đúng 1
Bình luận (0)
Hòa tan m gam Fe vừa đủ vào 150ml dd HCL chưa biết nồng độ. PHản ứng kết thúc thu được 3,36 lít khí H2(đktc)
a) Viết pthh xảy ra
b) tính khối lượng sắt đã phản ứng
c) Tính nồng độ mol của dd HCL đã dùng
a)
Fe+ 2HCl→ FeCl2+H2↑
b)
nH2= 0,15 mol
⇒ nFe= 0,15 mol⇒ mFe= 0,15.56=8,4 g
c)\(CM_{HCl}=\frac{0,15.2}{0,15}\text{ = 2M}\)
M.n giúp mk vs ạ
Bài 1
Cho 5.4g kim loại M vào dd HCl dư thu được 6.72 lít khí (đktc) . Xác định kim loại M
Bài 2
Cho M gam sắt tác dụng 50 ml dd HCl thu được 3.36 lít khí (đktc)
a) tính M gam sắt
b) Cm của HCl
Bài 3
Hòa tan 9.2g hỗn hợp kim loại Cu,Fe trong dung dịch H2SO4 loãng dư thu được 1.12 lít khí (đktc)
a) viết các pt phản ứng xảy ra
b) tính Khối lượng mỗi kim loại trong hỗn hợp
Đọc tiếp
M.n giúp mk vs ạ
Bài 1
Cho 5.4g kim loại M vào dd HCl dư thu được 6.72 lít khí (đktc) . Xác định kim loại M
Bài 2
Cho M gam sắt tác dụng 50 ml dd HCl thu được 3.36 lít khí (đktc)
a) tính M gam sắt
b) Cm của HCl
Bài 3
Hòa tan 9.2g hỗn hợp kim loại Cu,Fe trong dung dịch H2SO4 loãng dư thu được 1.12 lít khí (đktc)
a) viết các pt phản ứng xảy ra
b) tính Khối lượng mỗi kim loại trong hỗn hợp
1.
2M + 2xHCl \(\rightarrow\)2MClx + xH2
nH2=\(\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PTHH ta có:
nM=\(\dfrac{2}{x}\)nH2=\(\dfrac{0,6}{x}\)
MM=\(\dfrac{5,4}{\dfrac{0,6}{x}}=9x\)
Với x=3 thì MM=27
Vậy M là Al
Đúng 0
Bình luận (0)
Cho m gam bột sắt tác dụng hoàn toàn với dung dịch HCl 10% thu được 1,12lit khí hidro ( ở đktc )
a , Viết PTHH của phản ứng trên
b , Tính khối lượng bột sắt ( m )
c , Tính khối lượng dung dịch HCl cần dùng ( Biết : Fe = 56 ; H=1 )
Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.05......0.1...................0.05\)
\(m_{Fe}=0.05\cdot56=2.8\left(g\right)\)
\(m_{dd_{HCl}}=\dfrac{0.1\cdot36.5\cdot100}{10}=36.5\left(g\right)\)
Đúng 0
Bình luận (0)



























