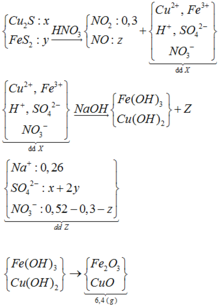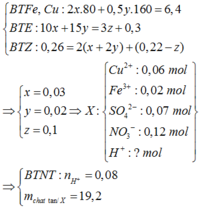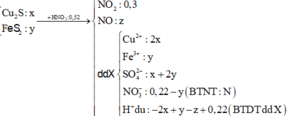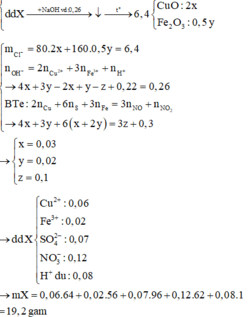cho dung dịch có chứa 10g naoh tác dụng với dung dịch có chứa 10g HNO3. Tính khối lượng các chất có trong dung dịch sau phản ứng.

Những câu hỏi liên quan
cho dung dịch chứa 10g NaOH tác dụng với dung dịch có chứa 10g HNO3:
a) tính khối lượng các chất có trong dung dịch sao phản ứng?
b) tính khối lượng NaOH hoặc HNO3 cần dùng để trung hòa dung dịch sau phản ứng ?
\(n_{NaOH}=0,25\:mol\\ n_{HNO_3}=\dfrac{10}{63}\)
\(PTHH:NaOH+HNO_3→NaNO_3+H_2O\\ \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: \: 0,25mol\: \: \: \: \: \: \dfrac{10}{63}mol\)
=> \(NaOH\:dư;\:HNO_3\:đủ\)
\(\Rightarrow\left[{}\begin{matrix}n_{NaNO_3}=\dfrac{10}{63}mol\\n_{H_2O}=\dfrac{10}{63mol}\end{matrix}\right.\Rightarrow\left[{}\begin{matrix}m_{NaNO_3}=\dfrac{10}{63}.85\approx13,5g\\m_{H_2O}=\dfrac{10}{63}.18\approx2,9g\end{matrix}\right.\)
\(m_{NaOH\: dư}=\left(0,25-\dfrac{10}{63}\right).41\approx3,74g\)
Đúng 0
Bình luận (2)
a) n NaOH =10/40 = 0,25 mol
nHNO3 =10/63 = 0,16 mol
Phản ứng:
NaOH + HNO3 ---> NaNO3 + H2O
Theo phương trình phản ứng thì n NaOH = n HNO3
Mà thực tế thì n NaOH > nHNO3 => NaOH dư => dung dịch sau phản ứng có tính kiềm
b) Sau phản ứng còn lại các dung dịch là: NaNO3 và NaOH dư
- nNaNO3 = n HNO3 = 0,16 mol => m= 0,16. 85 = 13,5g
- n NaOH dư =0,25 - 0,16= 0,04 mol => m= 0,04.40 = 1,6g
Đúng 0
Bình luận (0)
1/ Cho dung dịch có chứa 10g NaOH tác dụng với dung dịch có chứa 10g dung dịch HNO3
A) cho biết khối lượng các chất có trong dung dịch sau phản ứng
B) tính khối lượng NaOH hoặc HNO3 cần dùng để trung hoà dung dịch sau phản ứng
2/ Trộn 30ml dung dịch có chứa 2,22g CaCl2 với 70ml dung dịch có chứa 1,7 g AgNO3
A) Tính khối lượng chất kết tủa thu được ( AgCl)
B) Tính nồng độ mol các chất còn lại trong dung dịch sau phản ứng . Giả sử thể tích thay đổi ko đáng kể
Đọc tiếp
1/ Cho dung dịch có chứa 10g NaOH tác dụng với dung dịch có chứa 10g dung dịch HNO3
A) cho biết khối lượng các chất có trong dung dịch sau phản ứng
B) tính khối lượng NaOH hoặc HNO3 cần dùng để trung hoà dung dịch sau phản ứng
2/ Trộn 30ml dung dịch có chứa 2,22g CaCl2 với 70ml dung dịch có chứa 1,7 g AgNO3
A) Tính khối lượng chất kết tủa thu được ( AgCl)
B) Tính nồng độ mol các chất còn lại trong dung dịch sau phản ứng . Giả sử thể tích thay đổi ko đáng kể
Cho 10g MgO tác dụng với 400g dung dịch H2SO4 49% a. Viết PTHH của phản ứng xảy ra b. Tính khối lượng muối thu được sau phản ứng c. Tính nồng độ phần trăm các chất có trong dung dịch sau phản ứng
PTHH: \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{MgO}=\dfrac{10}{40}=0,25\left(mol\right)\\n_{H_2SO_4}=\dfrac{400\cdot49\%}{98}=2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư, MgO p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{MgSO_4}=0,25\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=1,75\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{MgSO_4}=0,25\cdot120=30\left(g\right)\\m_{H_2SO_4\left(dư\right)}=1,75\cdot98=171,5\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{MgO}+m_{ddH_2SO_4}=410\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{MgSO_4}=\dfrac{30}{410}\cdot100\%\approx7,31\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{171,5}{410}\cdot100\%\approx41,83\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Số mol của magie oxit
nMgO = \(\dfrac{m_{MgO}}{M_{MgO}}=\dfrac{10}{40}=0,25\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{49.400}{100}=196\left(g\right)\)
Số mol của axit sunfuric
nH2SO4= \(\dfrac{m_{H2SO4}}{M_{H2So4}}=\dfrac{196}{98}=2\left(mol\right)\)
a)Pt : MgO + H2SO4 → MgSO4 + H2O\(|\)
1 1 1 1
0,25 2 0,25
b) Lập tỉ số so sánh : \(\dfrac{0,25}{1}< \dfrac{2}{1}\)
⇒ MgO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol MgO
Số mol của muối magie sunfat
nMgSO4 = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
Khối lượng của muối magie sunfat
mMgSO4 = nMgSO4 . MMgSO4
= 0,25 . 120
= 30 (g)
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 2 - (0,25 . 1)
= 1,75 (g)
Khối lượng dư của dung dịch axit sunfuric
mdư = ndư . MH2SO4
= 1,75 . 98
= 171,5 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mMgO + mH2SO4
= 10 + 400
= 410 (g)
Nồng độ phần trăm của dung dịch magie sunfat
C0/0MgSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{30.100}{410}=7,32\)0/0
Nồng độ phần trăm của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{171,5.100}{410}=41,83\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Cho 40 ml dung dịch có chứa 15,2 gam CuSO4 tác dụng vừa đủ với dung dịch NaOH 2M
a) Tính khối lượng chất rắn thu được sau phản ứng và thể tích dung dịch NaOH cần dùng.
b) tính nồng độ mol các chất tan có trong dung dịch sau phản ứng?
c) Lọc lấy kết tủa nung trong không khí đến khối lượng không đổi thu được bao nhiêu gam chất rắn
\(n_{CuSO_4}=\dfrac{15,2}{160}=0,095mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,095 0,19 0,095 0,095
\(m_{rắn}=m_{Cu\left(OH\right)_2}=0,095.98=9,31g\\ V_{ddNaOH}=\dfrac{0,19}{2}=0,095l\\ b)C_{M_{Na_2SO_4}}=\dfrac{0,095}{0,04+0,095}\approx0,7M\\ c)Cu\left(OH\right)_2\xrightarrow[t^0]{}CuO+H_2O\)
0,095 0,095
\(m_{rắn}=m_{CuO}=0,095.80=7,6g\)
Đúng 2
Bình luận (0)
Cho một dung dịch chứa 10g NaOH tác dụng với 10g HNO3.
a) Dung dịch sau phản ứng làm quỳ tím đổi sang màu gì?
b)Tính khối lượng muối tạo thành?
a) nNaOH = 0,25 mol ; nHNO3 = \(\frac{10}{63}\) mol
NaOH + HNO3 ➝ NaNO3 + H2O
pứ: \(\frac{10}{63}\) \(\frac{10}{63}\)
bđ: 0,25 \(\frac{10}{63}\)
dư: 0,09 0
=> HNO3 phản ứng hết, NaOH dư, bài toán tính theo HNO3
Do dung dịch sau phản ứng có NaOH dư nên quỳ tím hóa xanh
b) nNaNO3 = nHNO3 = \(\frac{10}{63}\) mol
=> mNaNO3 ≃ 13,5 gam
Đúng 2
Bình luận (0)
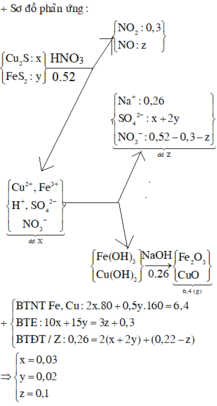
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây? A. 19,0 B. 21,0 C. 18,0 D. 20,0
Đọc tiếp
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây?
A. 19,0
B. 21,0
C. 18,0
D. 20,0
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng không đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây? A. 21,0 B. 19,0 C. 18,0 D. 20,0
Đọc tiếp
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng không đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây?
A. 21,0
B. 19,0
C. 18,0
D. 20,0
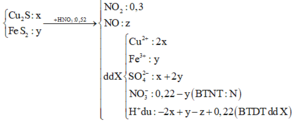
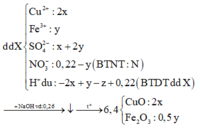
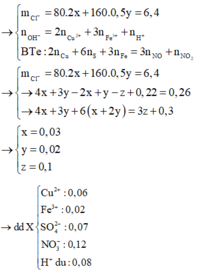
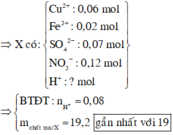
mX = 0,06.64 + 0,02.56 + 0,07.96 + 0,12.62 + 0,08.1 = 19,2(g)
Đáp án B
Đúng 0
Bình luận (0)
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây? A. 19,0. B. 21,0 C.18,0. D. 20,0.
Đọc tiếp
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng khôi đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây?
A. 19,0.
B. 21,0
C.18,0.
D. 20,0.
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng không đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây A. 21,0 B. 19,2 C. 18,0 D. 20,0
Đọc tiếp
Cho hỗn hợp gồm Cu2S và FeS2 tác dụng hết với dung dịch chứa 0,52 mol HNO3, thu được dung dịch X (không chứa NH4+) và hỗn hợp khí gồm NO và 0,3 mol NO2. Để tác dụng hết với các chất trong X cần dùng 260 ml dung dịch NaOH 1M, sau phản ứng lọc kết tủa nung trong không khí tới khối lượng không đổi thu được 6,4 gam chất rắn. Tổng khối lượng chất tan có trong dung dịch X gần nhất với giá trị nào sau đây
A. 21,0
B. 19,2
C. 18,0
D. 20,0