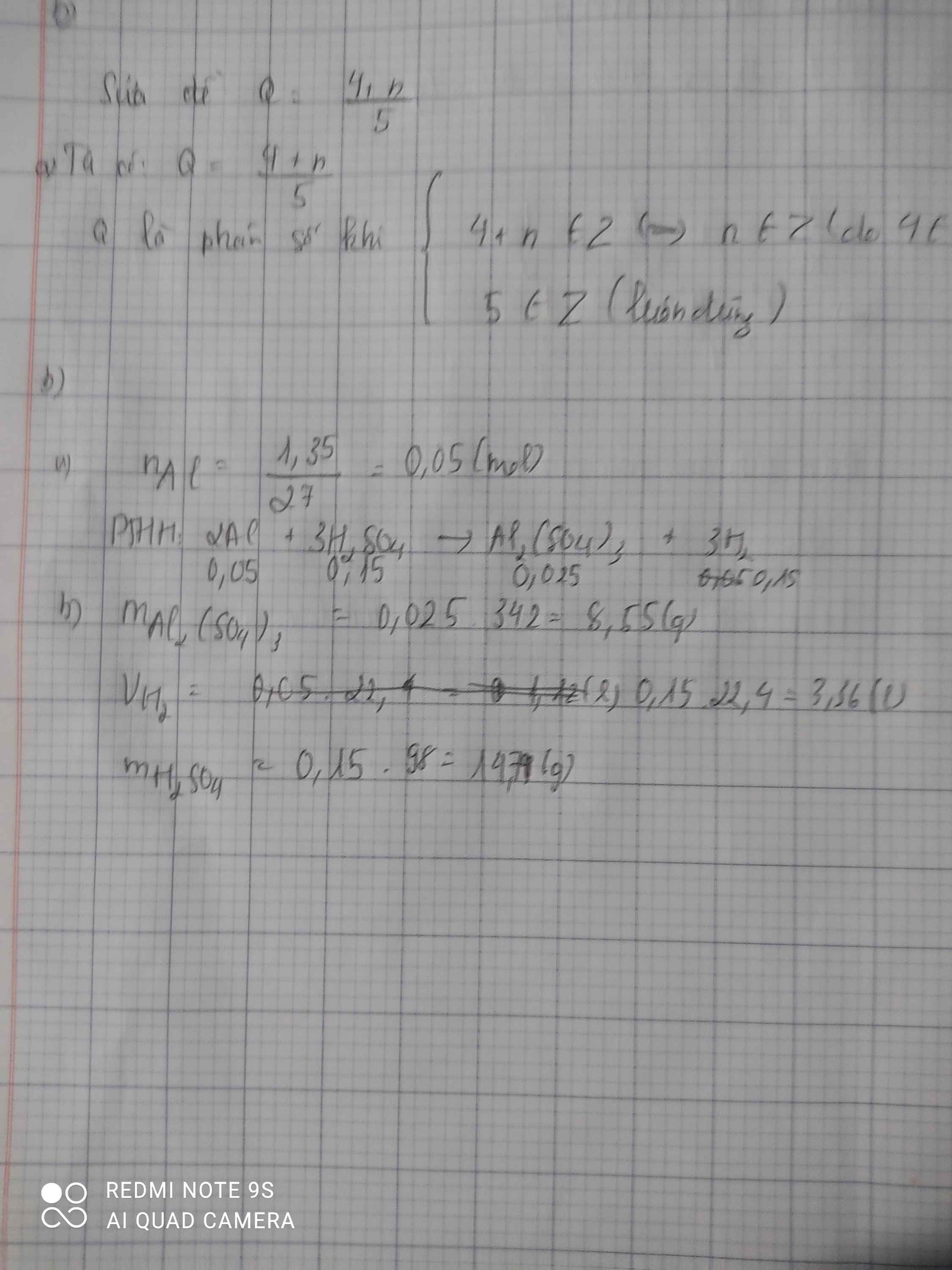cho 16,25 g kẽm vào dung dịch axitsufuric ( H2SO4 ) thu đc dung dịch có chứa 40,25 g kém sufat và 0,5 g khí Hidrro . tính khối lượng Axit Sunfuric

Những câu hỏi liên quan
Bài 1: cho 16,25 g kẽm (Zn) tác dụng hết với dung dịch axit sunfuric(H₂SO₄) loãng thu đc muối kẽm sunfat (ZnSO₄) và khí H₂a) Viết phương trình phản ứng xảy rab) Tính thể tích khí H₂ thu đc (đktc) và khối lượng muối kẽm sunfat(ZnSO₄) c) Dẫn an toàn bộ khí thu đc qua 36g CuO nung nóng , hãy tính khối lượng kim loại thu đc sau khi phản ứng xảy ra hoàn toàn
Đọc tiếp
Bài 1: cho 16,25 g kẽm (Zn) tác dụng hết với dung dịch axit sunfuric(H₂SO₄) loãng thu đc muối kẽm sunfat (ZnSO₄) và khí H₂
a) Viết phương trình phản ứng xảy ra
b) Tính thể tích khí H₂ thu đc (đktc) và khối lượng muối kẽm sunfat(ZnSO₄)
c) Dẫn an toàn bộ khí thu đc qua 36g CuO nung nóng , hãy tính khối lượng kim loại thu đc sau khi phản ứng xảy ra hoàn toàn
a)\(n_{Zn}=\dfrac{16,25}{65}=0,25mol\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,25 0,25 0,25 0,25
b)\(V_{H_2}=0,25\cdot22,4=5,6l\)
\(m_{Zn}=0,25\cdot65=16,25g\)
Dẫn toàn bộ \(0,25molH_2\) qua \(CuO\):
\(n_{CuO}=\dfrac{36}{80}=0,45mol\)
c)\(CuO+H_2\rightarrow Cu+H_2O\)
0,45 0,45
\(m_{Cu}=0,45\cdot64=28,8g\)
Đúng 3
Bình luận (0)
Câu 18. Cho kim loại kẽm vào axit sunfuric thu được dung dịch có chứa 24,15gam kẽm sunfat vào khí hiđrô(đkttc) a/ Nêu hiện tượng phản ứng trên?A. Sủi bọt khí B. dung dịch đổi màuC. Kết tủa trắng. D. Không hiện tượng.b/ Tính khối lượng axit H2SO4 cần dùng.A. 14. B. 14,5 C. 14,7 D.14,8b/ Tính thể tích khí hiđro tạo thành ở đktc.A. 0,56 B. 1,12 C. 2,8 D.3.36c/ Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hết lượng khí hidro trên.A. 3,36 B. 1,68 C. 11,2 D. 16,8 Câu 19. Thể tích (đktc) của 9.102...
Đọc tiếp
Câu 18. Cho kim loại kẽm vào axit sunfuric thu được dung dịch có chứa 24,15gam kẽm sunfat vào khí hiđrô(đkttc) a/ Nêu hiện tượng phản ứng trên?
A. Sủi bọt khí B. dung dịch đổi màu
C. Kết tủa trắng. D. Không hiện tượng.
b/ Tính khối lượng axit H2SO4 cần dùng.
A. 14. B. 14,5 C. 14,7 D.14,8
b/ Tính thể tích khí hiđro tạo thành ở đktc.
A. 0,56 B. 1,12 C. 2,8 D.3.36
c/ Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hết lượng khí hidro trên.
A. 3,36 B. 1,68 C. 11,2 D. 16,8
Câu 19. Thể tích (đktc) của 9.1023 phân tử khí H2
A.33,6 B. 2,8 C. 5,6 D.11,2
Câu 20. Hãy cho biết 6,72 lít khí oxi (đktc)
a/ Có bao nhiêu mol oxi?
A.0,12 B . 0,035 C.0,03 D. 0,3
b/ Có bao nhiêu phân tử khí oxi?
A. 1,7.1023 B. 1,5.1023 C 1,8.1023 D. 3.1023
c/ Có khối lượng bao nhiêu gam?
A . 12 B 9,6 C.9 D.11
d/ Cần phải lấy bao nhiêu gam khí N2 để có số phân tử gấp 4 lần số phân tử có trong 3.2 g khí oxi.
A . 11,2 B. 14 C 33 D. 23
Câu 21. Tính khối lượng của: 0,75 mol khí NO(đktc); 1,8.1023 phân tử NaCl; 8,96 lít khí CO2(đktc).
A. 53 B. 54 C. 55,65 D. 57,65
MÌNH CẦN LỜI GIẢI THÍCH CHI TIẾT Ạ
Câu 21. Tính khối lượng của: 0,75 mol khí NO(đktc); 1,8.1023 phân tử NaCl; 8,96 lít khí CO2(đktc).
A. 53 B. 54 C. 55,65 D. 57,6
\(m_{NO}=0,75.30=22,5g\)
\(m_{NaCl}=\left(\dfrac{1,8.10^{23}}{6.10^{23}}\right).58,5=17,55g\)
\(m_{CO_2}=\left(\dfrac{8,96}{22,4}\right).44=17,6g\)
\(\Rightarrow m_{hh}=22,5+17,55+17,6=57,6\) g
\(\Rightarrow D\)
< Bạn ơi, câu này mhh mình ra 57,6 g nên mình đổi đáp án câu D lại nhé! >
Đúng 3
Bình luận (0)
Câu 18. Cho kim loại kẽm vào axit sunfuric thu được dung dịch có chứa 24,15gam kẽm sunfat vào khí hiđrô(đkttc) a/ Nêu hiện tượng phản ứng trên?
A. Sủi bọt khí B. dung dịch đổi màu
C. Kết tủa trắng. D. Không hiện tượng.
b/ Tính khối lượng axit H2SO4 cần dùng.
A. 14. B. 14,5 C. 14,7 D.14,8
\(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{ZnSO_4}=\dfrac{24,15}{161}=0,15mol\)
\(m_{H_2SO_4}=0,15.98=14,7g\)
\(\Rightarrow\) Đáp án C
b/ Tính thể tích khí hiđro tạo thành ở đktc.
A. 0,56 B. 1,12 C. 2,8 D.3.36
\(V_{H_2}=0,15.22,4=3,36l\)
\(\Rightarrow\) Đáp án D
c/ Tính thể tích khí oxi (đktc) cần dùng để đốt cháy hết lượng khí hidro trên.
A. 3,36 B. 1,68 C. 11,2 D. 16,8
\(PTHH:2O_2+H_2\rightarrow2H_2O\)
\(n_{H_2}=0,15mol\)
\(n_{O_2}=\dfrac{0,15}{2}=0,075mol\)
\(\Rightarrow V_{O_2}=0,075.22,4=1,68l\)
\(\Rightarrow\) Đáp án B
Câu 19. Thể tích (đktc) của 9.1023 phân tử khí H2
A.33,6 B. 2,8 C. 5,6 D.11,2
\(n_{H_2}=\dfrac{9.10^{23}}{6.10^{23}}=1,5mol\)
\(V_{H_2}=1,5.22,4=33,6l\)
\(\Rightarrow A\)
Câu 20. Hãy cho biết 6,72 lít khí oxi (đktc)
a/ Có bao nhiêu mol oxi?
A.0,12 B . 0,035 C.0,03 D. 0,3
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\\ \Rightarrowđáp.án.D\)
b/ Có bao nhiêu phân tử khí oxi?
A. 1,7.1023 B. 1,5.1023 C 1,8.1023 D. 3.1023
\(Số.phân.tử.khí.O_2=0,3.6.10^{23}=1,8.10^{23}\) phân tử
\(\RightarrowĐáp.án.C\)
c/ Có khối lượng bao nhiêu gam?
A . 12 B 9,6 C.9 D.11
\(m_{O_2}=0,3.32=9,6g\)
\(\RightarrowĐáp.án.B\)
d/ Cần phải lấy bao nhiêu gam khí N2 để có số phân tử gấp 4 lần số phân tử có trong 3.2 g khí oxi.
A . 11,2 B. 14 C 33 D. 23
\(PTHH:N_2+O_2\rightarrow2NO\)
\(n_{O_2}=\dfrac{3,2}{32}=0,1mol\)
\(n_{N_2}=0,1.4=0,4mol\)
\(m_{N_2}=0,4.28=11,2g\)
\(\RightarrowĐáp.án.A\)
Đúng 3
Bình luận (3)
hòa tan hoàn toàn 19.5 g kẽm zn trong dung dịch axit sunfuric h2so4 thu được hẽm sunfat znso4 và khí hiđro h2
a viết pt hóa học
b tính khối lượng axit sunfuric cần dùng
c tính thể tích khí hiđro thu được(đktc)
d cho lượng khí hiđro trên tác dụng với sắt (III)oxit ở nhiệt độ cao.tính khối lượng sắt thu được
help pls
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ b) n_{H_2SO_4}= n_{H_2}= n_{Zn} = \dfrac{19,5}{65} =0,3(mol)\\ m_{H_2SO_4} = 0,3.98 = 29,4(gam)\\ c) V_{H_2} = 0,3.22,4 = 6,72(lít)\\ d) Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ n_{Fe} = \dfrac{2}{3}n_{H_2} = 0,2(mol)\\ m_{Fe} = 0,2.56 = 11,2(gam)\)
Đúng 2
Bình luận (0)
Cho 1,35 g kim loại nhôm (Al) tan hoàn toàn trong dung dịch axit sunfuric H2SO4 , thu được dung dịch chứa nhôm sunfat Al2(SO4)3 và khí hidro thoát ra .
b) Tính khối lượng Al2(SO4)3.
c) Tính thể tích khí Hidro (đktc)
d) Tính khối lượng H2SO4
\(n_{Al}=\dfrac{1,35}{27}=0,05\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow2Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2SO_4}=n_{H_2}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{0,05}{2}=0,025\left(mol\right)\\ a,m_{Al_2\left(SO_4\right)_3}=342.0,025=8,55\left(g\right)\\ b,V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ c,m_{H_2SO_4}=0,075.98=7,35\left(g\right)\)
Đúng 5
Bình luận (0)
\(n_{Al}=\dfrac{1,35}{27}=0,05mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,05 0,075 0,025 0,075
\(m_{Al_2\left(SO_4\right)_3}=0,025\cdot342=8,55g\)
\(V_{H_2}=0,075\cdot22,4=1,68l\)
\(m_{H_2SO_4}=0,075\cdot98=7,35g\)
Đúng 2
Bình luận (0)
bài
a) cho 21,6g al tác dụng hết với dung dịch h2so4 ( loãng ) thu đươc V (l) khí h2 . tìm v
b) cho 21,6g al vào dung dịch chứa 19,6 g axit sunfuric h2so4 ( loãng) thu đc V khí lít . tìm V
giúp mình với ạ , mình cảm ơn
a) nAl = 21,6/27 = 0,8 (mol)
PTHH: 2Al + 3H2SO4 -> Al2(SO43) + 3H2
nH2 = 0,8 : 2 . 3 = 1,2 (mol)
VH2 = 1,2 . 22,4 = 26,88 (l)
b) nH2SO4 = 19,6/98 = 0,2 (mol)
LTL: 0,8/2 > 0,2/3 => Al dư
nH2 = nH2SO4 = 0,2 (mol)
VH2 = 0,2 . 22,4 = 4,48 (l)
Đúng 4
Bình luận (1)
Cho 19,5g kim loại kẽm phản ứng vừa đủ với dung dịch axit clohidric loãng. Sau phản ứng thu được 6,72 l khí hiđro ở đktc và dung dịch có chứa 40,8 g muối kẽm .Tính khối lượng axit clohidric đã phản ứng.
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
Đúng 1
Bình luận (0)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo ĐLBTKL:
mZn + mHCl = mH2 + mZnCl2
=> mHCl = 40,8 + 0,3.2 - 19,5 = 21,9(g)
Đúng 3
Bình luận (0)
Cho 6,5 g kẽm tác dụng với dung dịch HCl thu được 136 g ZnCl2 và 24,79 lít khí H2 (đkc).a) Lập pthh.b) Tính khối lượng HCl?c) Cho lượng khí H2 vừa thu được vào bình chứa 0,5 mol khí CO2 và 0,35 mol khí Cl2. Tính thể tích hỗn hợp và khối lượng hỗn hợp khí trong bình.
Đọc tiếp
Cho 6,5 g kẽm tác dụng với dung dịch HCl thu được 136 g ZnCl2 và 24,79 lít khí H2 (đkc).
a) Lập pthh.
b) Tính khối lượng HCl?
c) Cho lượng khí H2 vừa thu được vào bình chứa 0,5 mol khí CO2 và 0,35 mol khí Cl2. Tính thể tích hỗn hợp và khối lượng hỗn hợp khí trong bình.
Sửa đề: Cho \(65g\) kẽm
\(a,PTHH:Zn+2HCl\to ZnCl_2+H_2\\ b,n_{H_2}=\dfrac{24,79}{24,79}=1(mol)\\ \Rightarrow m_{H_2}=1.2=2(g)\\ \text {Bảo toàn KL}:m_{HCl}=m_{ZnCl_2}+m_{H_2}-m_{Zn}=136+2-65=73(g)\)
Đúng 1
Bình luận (0)
75. Cho 3,25 g kẽm tác dụng vừa đủ với dung dịch chứa 4,9 g axit sunfuric thu được 8,05 g muối kẽm
sunfat và m g khí hidro. m có giá trị là?
Theo ĐLBTKL: mZn + mH2SO4 = mZnSO4 + mH2
=> mH2 = 3,25 + 4,9 - 8,05 = 0,1(g)
Đúng 1
Bình luận (0)
Cho 13g kẽm phản ứng hoàn toàn vừa đủ với dung dịch axit sunfuric 20 %a. Tính thể tích khí hidro sinh ra ( đktc ) b.Tính khối lượng dung dịch axit sunfuric cần dùng c. Tính nồng độ mol của dd axit sunfuric biết khối lượng riêng của axit là 1,14 g / mlMk cần gấp câu c ạ!!!!! Thanks trc
Đọc tiếp
Cho 13g kẽm phản ứng hoàn toàn vừa đủ với dung dịch axit sunfuric 20 %
a. Tính thể tích khí hidro sinh ra ( đktc ) b.Tính khối lượng dung dịch axit sunfuric cần dùng c. Tính nồng độ mol của dd axit sunfuric biết khối lượng riêng của axit là 1,14 g / ml
Mk cần gấp câu c ạ!!!!! Thanks trc![]()
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
0,2--->0,2--------->0,2------>0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\\ m_{H_2SO_4}=\dfrac{0,2.98}{20\%}=98\left(g\right)\\ \rightarrow V_{ddH_2SO_4}=\dfrac{98}{1,14}=86\left(ml\right)=0,086\left(l\right)\\ \rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{0,2}{0,086}=2,33M\)
Đúng 1
Bình luận (0)