oxit kim loại M có khối lượng phân tử là 80 và M có hóa trị không đổi.Hãy tìm M

Những câu hỏi liên quan
Cho oxit MxOy của kim loại M có hóa trị không đổi.Hãy xác định công thức của oxit trên biết rằng 3,06g oxit nguyên chất tan trong dung dịch HNO3 dư thu đc 5,22g muối.Xác định CTHH của oxit trên
\(M_xO_y+2yHNO3\rightarrow xM\left(NO_3\right)_{\dfrac{2y}{x}}+yH_2O\)
\(TheoPTHH:n_{MxOy}=\dfrac{1}{x}n_{M\left(NO_3\right)_{\dfrac{2y}{x}}}=\dfrac{3,06}{Mx+16y}=\dfrac{1}{x}\left(\dfrac{5,22}{M+62\left(\dfrac{2y}{x}\right)}\right)\)
\(=\dfrac{3,06}{Mx+16y}=\dfrac{5,22}{xM+124y}\)
\(\Leftrightarrow5,22Mx+83,52y=3,06Mx+379,44y\)
\(\Leftrightarrow2,16Mx=295,92y\)
\(\Leftrightarrow M=\dfrac{y}{x}.137\)
- Thấy \(x=y=1,M=137\left(TM\right)\)
Vậy CTHH của oxit trên là BaO
Đúng 3
Bình luận (0)
1 oxit của kim loại hóa trị ll có phân tử khối là 80.Tìm kim loại đó? Mong các sư huynh trả lời:(
gọi CTHH của kim loại đó là: `R`
vì kim loại hóa trị II nên áp dụng quy tắc hóa trị thì CTHH của oxit đó là
`RO`
\(PTK\left(RO\right)=80\left(dvC\right)\\ =>PTK\left(R\right)=80-16=64\left(dvC\right)\)
Vậy kim loại đó là Đồng `(Cu)`
Đúng 1
Bình luận (0)
X và Y là 2 oxit của cùng 1 kim loại M. Biết hoà tan cùng một lượng oxit X như nhau đến hoàn toàn trong HNO3 và HCl rồi cô cạn dung dịch thì được những lượng muối nitrat và clorua của kim loại M có cùng hoá trị. Ngoài ra, khối lượng muối nitrat và clorua của kim loại M có cùng hoá trị. Ngoài ra, khối lượng muối nitrat khan lớn hơn khối lượng muối clorua khan một lượng bằng 99,38% khối lượng oxit đem hoà tan trong mỗi axit. Phân tử khối của Y bằng 45% phân tử khối của X. Xác định các oxit X và Y...
Đọc tiếp
X và Y là 2 oxit của cùng 1 kim loại M. Biết hoà tan cùng một lượng oxit X như nhau đến hoàn toàn trong HNO3 và HCl rồi cô cạn dung dịch thì được những lượng muối nitrat và clorua của kim loại M có cùng hoá trị. Ngoài ra, khối lượng muối nitrat và clorua của kim loại M có cùng hoá trị. Ngoài ra, khối lượng muối nitrat khan lớn hơn khối lượng muối clorua khan một lượng bằng 99,38% khối lượng oxit đem hoà tan trong mỗi axit. Phân tử khối của Y bằng 45% phân tử khối của X. Xác định các oxit X và Y?
gọi Cthuc Oxit X là M2On : Y là : M2Om
Ta có Pt; M2On + 2nHNO3-> 2M(NO3)n+ nH2O
M2On + 2nHCl2-> 2MCln+ nH2O
- Tự chọn lượng chất: Gọi số gam oxit X là (2M+16n)gam hay 1 mol
ta có 2(M+62n)-2(M+35,5n)= 99,38( 2M+16n)/100
Gia ra:
M=18,7n
biện luân với n= 1,2,3
Nhận n=3 =>M =56
Vậy X là Fe2O3
Từ Phân tử khối của oxit Y bằng 45% phân tử khối của oxit X
=> Y: FeO
Đúng 0
Bình luận (0)
bạn ơi, cho mình hỏi bài này trong sách gì vậy ạ???
Đúng 0
Bình luận (0)
Nguyên tố R tạo một oxit RO2 (chất D) và một hợp chất RHn (chất E). Cho biết khối lượng riêng hơi của E ở dktc là 1,5179g/ml và phân tử khối của D là 32/17 phân tử khối của E.a) Tìm nguyên tố Rb) M là kim loại hóa trị I, tạo được muối X có công thức M2RO3. Hòa tan 12,6g X trong 100ml dd HCl lấy dư có D 1,2g/ml. Sau phản ứng thu được 126,2g dd. Tìm kim loại M
Đọc tiếp
Nguyên tố R tạo một oxit RO2 (chất D) và một hợp chất RHn (chất E). Cho biết khối lượng riêng hơi của E ở dktc là 1,5179g/ml và phân tử khối của D là 32/17 phân tử khối của E.
a) Tìm nguyên tố R
b) M là kim loại hóa trị I, tạo được muối X có công thức M2RO3. Hòa tan 12,6g X trong 100ml dd HCl lấy dư có D = 1,2g/ml. Sau phản ứng thu được 126,2g dd. Tìm kim loại M
a) MD = R + 32 (g/mol)
ME = R + n (g/mol)
Theo đề bài \(\dfrac{M_D}{M_E}\)= \(\dfrac{R+32}{R+n}\)= \(\dfrac{32}{17}\) => \(\left\{{}\begin{matrix}n=2\\R=32\end{matrix}\right.\) là giá trị thỏa mãn
Vậy R là lưu huỳnh (S)
b) m 100ml dung dịch HCl = 1,2.100 = 120 gam
M2SO3 + 2HCl → 2MCl + SO2↑ + H2O
m dung dịch sau phản ứng = m M2SO3 + m dung dịch HCl - m SO2 = 126,2 gam
=> 12,6 + 120 - 126,2 = mSO2
<=> mSO2 = 6,4 gam , nSO2 = 6,4 : 64 = 0,1 mol
Theo phương trình phản ứng , nM2SO3 = nSO2 = 0,1 mol
=> MM2SO3 = \(\dfrac{12,6}{0,1}\)= 126 (g/mol)
=> MM = (126 - 32 - 16.3) : 2 = 23 g/mol
Vậy M là natri (Na)
Đúng 3
Bình luận (2)
M là oxit của kim loại X (hóa trị II). Biết 0,2 mol oxit M có khối lượng là 11,2 gam.
Nguyên tố X là:
Công thức của oxit `M` đó là: `XO`
`=>M_[XO]=[11,2]/[0,2]=56(g//mol)`
`=>M_X=56-16=40(g//mol)`
`->X` là `Ca`
Đúng 9
Bình luận (0)
nguyên tố kim loại m có hóa trị không đổi khi liên kết với oxi tạo thành hợp chất có phân tử khối là 102.Xác định kim loại M
Gọi hóa trị M là n
=> CT gọi chung: M2On
Ta có: PTK(M2On)=102
<=>2NTK(M)+16.n= 102
=> Ta xét lần lượt n=1,n=2, n=8/3, n=3 thấy chỉ có n=3 thỏa mãn với M là nhôm (Al=27)
Đúng 2
Bình luận (0)
\(CTTQ:M_xO_y\)
Thường thì kim loại sẽ chủ yếu hoá trị từ \(1\rightarrow3\) nên sẽ xét số Oxi từ \(1\rightarrow3\)
| \(x\) | \(y\) | \(M=?\) |
| \(1\) | \(1\) | \(86\left(L\right)\) |
| \(1\) | \(2\) | \(70\left(L\right)\) |
| \(1\) | \(3\) | \(54\left(L\right)\) |
| \(2\) | \(1\) | \(43\left(L\right)\) |
| \(2\) | \(3\) | \(27\left(N\right)\) |
Vậy \(M:Al\) (Nhôm)
Đúng 2
Bình luận (0)
PTHH: M + O2 ----to→ M2Ox
Ta có: \(2M_M+xM_O=102\)
\(\Leftrightarrow2M_M+16x=102\Leftrightarrow2M_M=102-16x\)
Vì M là kim loại nên M có hóa trị I,II,III
Ta có bảng:
| x | I | II | III |
| 2MM | 86 | 70 | 54 |
| MM | 43 | 35 | 27 |
| Kết luận | loại | loại | thỏa mãn |
Vậy M là kim loại nhôm (Al)
Đúng 1
Bình luận (0)
Một loại oxit đồng màu đen có khối lượng mol phân tử là 80g. Oxit này có thành phần là 80% Cu và 20% O. Hãy tìm công thức hóa học của loại oxit đồng nói trên.
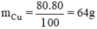
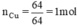 nguyên tử Cu.
nguyên tử Cu.
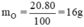
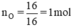 nguyên tử O.
nguyên tử O.
Suy ra trong 1 phân tử hợp chất có 1 nguyên tử Cu và 1 nguyên tử O.
Do đó công thức của oxit đồng màu đen là CuO.
Đúng 0
Bình luận (0)
1. Oxit đồng có công thức CuxOy và có mCu : mO 4 : 1. Tìm công thức oxit. 2. X là oxit của một kim loại M chưa rõ hoá trị. Biết tỉ lệ về khối lượng của M và O bằng 7:3. Xác định công thức hóa học của X? 3. Oxit cao nhất của một nguyên tố có công thức R2Ox phân tử khối của oxit là 102 đvC, biết thành phần khối lượng của oxi là 47,06%. Xác định R. ...
Đọc tiếp
1. Oxit đồng có công thức CuxOy và có mCu : mO = 4 : 1. Tìm công thức oxit.
2. X là oxit của một kim loại M chưa rõ hoá trị. Biết tỉ lệ về khối lượng của M và O bằng 7:3. Xác định công thức hóa học của X?
3. Oxit cao nhất của một nguyên tố có công thức R2Ox phân tử khối của oxit là 102 đvC, biết thành phần khối lượng của oxi là 47,06%. Xác định R.
4.Oxit kim loại R có hóa trị III. Biết trong oxit thì oxi chiếm 30% về khối lượng. Xác định CTHH của oxit
1)
Có mCu : mO = 4 : 1
=> 64.nCu : 16.nO = 4:1
=> nCu : nO = 1:1
=> CTHH: CuO
2) CTHH: MxOy
\(\dfrac{M_M.x}{16y}=\dfrac{7}{3}\)
=> \(M_M=\dfrac{112y}{3x}=\dfrac{2y}{x}.\dfrac{56}{3}\)
Xét \(\dfrac{2y}{x}=1\) => L
Xét \(\dfrac{2y}{x}=2\) => L
Xét \(\dfrac{2y}{x}=3\) => MM = 56(Fe) => \(\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTHH: Fe2O3
3)
\(m_O=\dfrac{47,06.102}{100}=48\left(g\right)=>n_O=\dfrac{48}{16}=3\left(mol\right)\)=> x = 3
=> MR2O3 = 102
=> MR = 27(Al)
4)
CTHH: R2O3
\(\dfrac{16.3}{2.M_R+16.3}.100\%=30\%=>M_R=56\left(Fe\right)\)
=> Fe2O3
Đúng 2
Bình luận (1)
đun nóng m gam kim loại M có hóa trị không đổi trong không khí đến khi phản ứng xảy ra hoàn toàn thì thu được oxit có khối lượng 1,25m gam .Để hòa tan hết lượng oxit trên cần 200 g dung dịch H2SO4 19,6% thu được dung dịch X .Xác định kim loại M .Tính nồng độ phần trăm C% của chất tan có trong dung dịch X
Gọi n là hóa trị của M
Phản ứng xảy ra:
4M+nO2→2M2On
Giả sử số mol M là 1 mol.
→nM2On=1/2nM=0,5 mol
→mM=m=1M(M)=M(M)gam
mM2On=0,5.(2MM+16MO)=0,5(2MM+16n)=MM+8n=1,25m
→MM+8n=1,25MM→MM=32n→n=2→MM=64→M:Cu(Đồng)
Hòa tan oxit
CuO+H2SO4→CuSO4+H2O
Ta có:
mH2SO4=200.19,6%=39,2 gam
→nH2SO4=39,298=0,4 mol = nCuO=nCuSO4
→mCuO=0,4.(64+16)=32 gam;mCuSO4=0,4.(64+96)=64 gam
Áp dụng định luật bảo toàn khối lượng:
mddX=mCuO+mddH2SO4=200+32=232 gam
→C%CuSO4=64232=27,5862%
chúc bạn học tốt
Đúng 0
Bình luận (0)
Gọi n là hóa trị của M Phản ứng xảy ra: 4M+nO2→2M2On
Giả sử số mol M là 1 mol.
→nM2On=1/2nM=0,5 mol →mM=m=1M(M)=M(M)gam
mM2On=0,5.(2MM+16MO)=0,5(2MM+16n)=MM+8n=1,25m →MM+8n=1,25MM→MM=32n→n=2→MM=64→M:Cu(Đồng)
Đúng 0
Bình luận (0)
Đốt cháy 1 lượng kim loại M chưa rõ hóa trị cần 6,72 lít oxi(đktc) tạo ra 20,4g oxit . Tìm kim loại M và khối lượng M đã phản ứng.
\(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo ĐLBTKL: mM + mO2 = mMxOy
=> mM = 20,4 - 0,3.32 = 10,8(g)
\(n_M=\dfrac{10,8}{M_M}\left(mol\right)\)
PTHH: 2xM + yO2 --to--> 2MxOy
_____\(\dfrac{10,8}{M_M}\) ->\(\dfrac{10,8y}{2x.M_M}\)
=>\(\dfrac{10,8y}{2x.M_M}=0,3\)
=> \(M_M=9.\dfrac{2y}{x}\)
Xét \(\dfrac{2y}{x}=1=>L\)
Xét \(\dfrac{2y}{x}=2=>L\)
Xét \(\dfrac{2y}{x}=3=>M_M=27\left(Al\right)\)
Đúng 1
Bình luận (0)




























