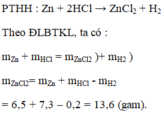2. Nghiên cứu tổng khối lượng các chất trước và sau phản ứng hóa học. Làm thế nào có thể biết được tổng khối lượng của các chất trước phản ứng hóa học và tổng khối lượng của các chất sau phản ứng hóa học có thay đổi hay không? Hãy thực hiện thí nghiệm (ghi hiện tượng và kết quả thu được vào bảng 1.3):- Lấy 2 - 3 mảnh/viên kẽm nhỏ, dùng giấy ráp đánh nhẹ cho hết lớp oxit mỏng ở phía ngoài (1), sau đó dùng cân kĩ thuật/cân điện tử/bộ cảm biến để cân tổng khối lượng của các mảnh/viên. - Lấy 50 ml d...
Đọc tiếp
2. Nghiên cứu tổng khối lượng các chất trước và sau phản ứng hóa học.
Làm thế nào có thể biết được tổng khối lượng của các chất trước phản ứng hóa học và tổng khối lượng của các chất sau phản ứng hóa học có thay đổi hay không?
Hãy thực hiện thí nghiệm (ghi hiện tượng và kết quả thu được vào bảng 1.3):
- Lấy 2 - 3 mảnh/viên kẽm nhỏ, dùng giấy ráp đánh nhẹ cho hết lớp oxit mỏng ở phía ngoài (1), sau đó dùng cân kĩ thuật/cân điện tử/bộ cảm biến để cân tổng khối lượng của các mảnh/viên.
- Lấy 50 ml dung dịch muối đồng sunfat CuSO4 nồng độ khoảng 0,5M cho vào các cốc thủy tinh sạch (loại 100 ml) (2), dùng cân kĩ thuật/cân điện tử/ bộ cảm biến để cân khối lượng cốc đựng dung dịch muối đồng sunfat.
- Cho các mảnh/viên kẽm (1) vào cốc đựng dung dịch muối đồng sunfat (2), quan sát hiện tượng xảy ra trong khoảng 3 phút, nhận xét về sự thay đổi màu sắc của dung dịch muối đồng sunfat và các mảnh/viên kẽm.
- Dùng cân kĩ thuật/cân điện tử/bộ cảm biến để cân lại tổng khối lượng của cốc đựng dung dịch muối đồng sunfat và các mảnh/viên kẽm sau thí nghiệm.
Trả lời các câu hour sau:
a) Nhận xét về tổng khối lượng của các cốc đựng dung dịch muối đồng sunfat và các mảnh/viên kẽm sau thí nghiệm so với tổng khối lượng của các mảnh/viên kẽm và khối lượng cốc đựng dung dịch muối đồng sunfat trước thí nghiệm.
b) So sánh các số liệu thu được của nhóm em với số liệu của các nhóm khác (giống nhau, khác nhau). Giải thích.