Cho 2,1g kim loại A có hóa trị I vào nước dư thu được lượng khí H2 nhỏ hơn 1,12 lít (dktc). Nếu cho 8,2g kim loại A vào nước dư thu được lượng khí H2 thoát ra vượt quá 2,24 lít (Đktc). Xác định kim loại A.

Những câu hỏi liên quan
Cho 2,1g kim loại A có hóa trị I vào nước dư thu được lượng khí H2 nhỏ hơn 1,12 lít (dktc). Nếu cho 8,2g kim loại A vào nước dư thu được lượng khí H2 thoát ra vượt quá 2,24 lít (Đktc). Xác định kim loại A.
2A +H2O ----> H2 +A2O
trường hợp 1: nH2< 0,05 => nA< 0,1 => MA > 2,1/0,1=21
trường hợp 2:nH2>0,1 => nA> 0,2 => MA < 41
=> A là Rb(37,hóa trị I )
Đúng 0
Bình luận (1)
theo mik thì là như vậy :
2A +H2O ----> H2 +A2O
trường hợp 1: nH2< 0,05 => nA< 0,1 => MA > 2,1/0,1=21
trường hợp 2:nH2>0,1 => nA> 0,2 => MA < 41
=> A là Rb(37,hóa trị I )
Chúc bn học tốt
Đúng 0
Bình luận (0)
2A + H20 ---> H2 + A20
Trường hợp 1 : nH2 < 0,05 \(\Rightarrow\) nA < 0,1 => MA > 2,1 / 0,1 = 21
Trường hợp 2 : nH2 > 0,1 => nA > 0,2 => MA < 41
=> A là Rb ( 37 , hóa trị l )
Đúng 0
Bình luận (1)
Cho 2,1 gam kim loại A hoá trị I vào nước dư thu được lượng H2 nhỏ hơn 1,12 lít khí ở(đkt). Nếu cho 8,2 gam kim loại A vào nước dư thì lượng H2 thoát ra vượt quá 2,24 lít ở (đkt). Xác định kim loại A ?
Tham khảo:
2A+ 2H2O -> 2AOH+ H2
- TN1:
nH2= 0,05 mol
nA= 2,1/A mol
=> 1,05/A < 0,05
=> A > 21 (1)
- TN2:
nH2= 0,1 mol
nA= 8,2/A mol
=> 4,1/A > 0,1
=> A < 41 (2)
(1)(2) => 21 < A < 41
Vậy A= 23 (Na) hoặc A= 39 (K)
Đúng 2
Bình luận (1)
Cho 2,1 gam kim loại A hoá trị I vào nước dư thu được lượng H2 nhỏ hơn 1,12 lít khí ở(đkt). Nếu cho 8,2 gam kim loại A vào nước dư thì lượng H2 thoát ra vượt quá 2,24 lít ở (đkt). Xác định kim loại A ?
2A + H20 ---> H2 + A20
Trường hợp 1 : nH2 < 0,05 ⇒⇒ nA < 0,1 => MA > 2,1 / 0,1 = 21
Trường hợp 2 : nH2 > 0,1 => nA > 0,2 => MA < 41
=> A là Rb ( 37 , hóa trị l )
Đúng 3
Bình luận (0)
Cho 2,1 gam kim loại A hóa trị I vào nước dư thu được lượng khí H2 nhỏ hơn 1,12 lít (dktc). Nếu cho 8,2g kim loại A vào nước dư thu được lượng khí H2 thoát ra vượt quá 2,24 lít (Đktc). Xác định kim loại A.
2A + H2O \(\rightarrow\) H2 + A2O
Trường hợp 1 : nH2 < 0,05 \(\Rightarrow\) nA < 0,1 \(\Rightarrow\) MA > 2,1/0,1 = 21
Trường hợp 2 : nH2 > 0,1 \(\Rightarrow\) nA > 0,2 \(\Rightarrow\) MA < 41
\(\Rightarrow\) A là Rb ( 37 , hóa trị 1 )
Đúng 1
Bình luận (0)
Cho 2,1g kim loại A hoá trị I vào nước(dư) thu đc lượng H2 nhỏ hơn 1,12 lít khí (đktc). Nếu cho 8,2g kim loại A tan hết trong nước thì lượng H2 thoát ra vượt quá 2,24 lít(đktc). Xác định kim loại A
\(n_{A\left(1\right)}=\frac{2,1}{A}\left(mol\right);n_{A\left(2\right)}=\frac{8,2}{A}\left(mol\right)\)
PTHH 1: 2A + 2H2O --> 2AOH + H2
\(\frac{2,1}{A}\) -------------------------> \(\frac{1,05}{A}\) (mol)
PTHH 2: 2A + 2H2O --> 2AOH + H2
\(\frac{8,2}{A}\) --------------------------> \(\frac{4,1}{A}\) (mol)
=> \(\frac{1,05}{A}< \frac{1,12}{22,4}\) ; \(\frac{4,1}{A}>\frac{2,24}{22,4}\)
=> \(\frac{1,05}{A}< 0,05\); \(\frac{4,1}{A}>0,1\)
=> 21<A<41 => A là Na,K
MIK NGHĨ ZẬY
\(2A+2H_2O\rightarrow2Aoh+H_2\)
- TN1:
\(n_{H2}=0,05\left(mol\right)\)
\(n_A=\frac{2,1}{A}\left(mol\right)\)
\(\Rightarrow\frac{1,05}{A}< 0,05\Rightarrow A>21\left(1\right)\)
- TN2:
\(n_{H2}=0,1\left(mol\right)\)
\(n_A=\frac{8,2}{A}\left(mol\right)\)
\(\Rightarrow\frac{4,1}{A}>0,1\Rightarrow A< 41\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow21< A< 41\)
Vậy A= 23 (Na) hoặc A= 39 (K)
1, cho 14,2g P2O4 vào cốc chứa 45g nước tạo ra dd axit
a, chất nào còn dư và dư bao nhiêu gram
b, tính khối lượng axit thu được
2, hòa tan 4g kim loại hóa trị II vào nc thu đc 2,24 lít H2 (đktc) xác định tên kim loại
3, hòa tan 15,6g kim loại hóa trị I vào nước thu đc 4,48 lít khí H2 xác định tên kim loại
2) Gọi kim loại hóa trị II là x
X + 2H2O → X(OH)2 + H2
nH2 = 2,24:22,4 =0,1 mol
nX = \(\dfrac{4}{^MX}\)=nH2
=> \(\dfrac{4}{^MX}\)=0,1 => MX=40 => X là kim loại Canxi (Ca)
Đúng 3
Bình luận (0)
Bài 1:
a, Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{45}{18}=2,5\left(mol\right)\)
PT: \(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{2,5}{3}\), ta được H2O dư.
Theo PT: \(n_{H_2O\left(pư\right)}=3n_{P_2O_5}=0,3\left(mol\right)\)
\(\Rightarrow n_{H_2O\left(dư\right)}=2,5-0,3=2,2\left(mol\right)\)
\(\Rightarrow m_{H_2O\left(dư\right)}=2,2.18=39,6\left(g\right)\)
b, Theo PT: \(n_{H_3PO_4}=2n_{P_2O_5}=0,2\left(mol\right)\)
\(\Rightarrow m_{H_3PO_4}=0,2.98=19,6\left(g\right)\)
Bạn tham khảo nhé!
Đúng 3
Bình luận (0)
Bài 2: Giả sử KL cần tìm là A.
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: \(A+2H_2O\rightarrow A\left(OH\right)_2+H_2\)
___0,1___________________0,1 (mol)
\(\Rightarrow M_A=\dfrac{4}{0,1}=40\left(g/mol\right)\)
Vậy: A là Canxi (Ca).
Bài 3:
Giả sử kim loại cần tìm là B.
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2B+2H_2O\rightarrow2BOH+H_2\)
___0,4__________________0,2 (mol)
\(\Rightarrow M_B=\dfrac{15,6}{0,4}=39\left(g/mol\right)\)
Vậy: B là Kali (K).
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
hòa tan 5,6g kim loại x, hóa trị II vào cốc có chứa HCL dư. sau phản ứng thu được 2,24 lít khí H2 (dktc). Xác định khối lượng muối sau phản ứng ?
nH2=2,24/22,4=0,1(mol)
PTHH: X + 2 HCl -> XCl2 + H2
Ta có: nX=nXCl2=nH2=0,1(mol)
=> M(X)=mX/nX=5,6/0,1=56(g/mol)
=>XCl2 là FeCl2
=> m(muối)=mFeCl2=127.0,1=12,7(g)
Đúng 1
Bình luận (0)
Hỗn hợp X gồm Fe và kim loại M có hóa trị không đổi. Cho 15,2 gam X tác dụng với dung dịch HC1 dư, thấy thoát ra 2,24 lít khí H2 (đktc). Nếu cho lượng X như trên tác dụng với dung dịch HNO3 dư, thu được 4,48 lít khí NO (đktc). Kim loại M là A. Ag. B. Cu. C. Al. D. Mg.
Đọc tiếp
Hỗn hợp X gồm Fe và kim loại M có hóa trị không đổi. Cho 15,2 gam X tác dụng với dung dịch HC1 dư, thấy thoát ra 2,24 lít khí H2 (đktc). Nếu cho lượng X như trên tác dụng với dung dịch HNO3 dư, thu được 4,48 lít khí NO (đktc). Kim loại M là
A. Ag.
B. Cu.
C. Al.
D. Mg.
Đáp án B
n H 2 = 0 , 1 ; n NO = 0 , 4 . Gọi n là hóa trị của M.
Căn cứ vào 4 đáp án ta có 2 trường hợp:
+) M là kim loại đứng trước H trong dãy hoạt động hóa học. Khi đó cả M và Fe có phản ứng với dung dịch HCl. Vì hóa trị của M không đổi nên sự chênh lệch về số electron trao đổi trong hai lần thí nghiệm là do sắt có hai mức hóa trị là II và III.
Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có: 2 n Fe + n . n M = 2 n H 2
- Khi hòa tan hỗn hợp vào dung dịch HNO3, ta có: 3 n Fe + n . n M = 3 n NO
Trừ hai vế của hai phương trình cho nhau, ta được:
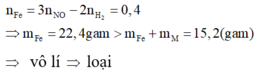
+) M là kim loại đứng sau H và trước Pt trong dãy hoạt động hóa học. Khi đó M không phản ứng được với dung dịch HCl và phản ứng được với dung dịch HNO3. Áp dụng định luật bảo toàn mol electron:
- Khi hòa tan hỗn hợp vào dung dịch HCl, ta có:

Đúng 0
Bình luận (0)
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại ABài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Đọc tiếp
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (1)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
Đúng 1
Bình luận (0)






























