tính số nguyên tử kẽm có trong 1,08 g kẽm

Những câu hỏi liên quan
tìm số nguyên tử có kẽm trong 16,25g kẽm
nZn = 16,25 / 65 = 0,25 (mol)
=> Số nguyên tử Zn = \(0,25\times6\times10^{23}=1,5\times10^{23}\)
Đúng 0
Bình luận (0)
nZn=m:M=16,25:65=0,25(mol)
NZn=n.6.1023=0,25.6.1023=1,5.1023
Đúng 0
Bình luận (0)
a. Tính số nguyên tử có trong 0,8 mol nguyên tử kẽm (Zn).
b. Tính số mol của 2,1.10^23 phân tử Hydrochloric acid (HCl).
a.
Số nguyên tử Zn :
\(0.8\cdot6\cdot10^{23}=4.8\cdot10^{23}\left(nt\right)\)
\(b.\)
\(n_{HCl}=\dfrac{2.1\cdot10^{23}}{6\cdot10^{23}}=0.35\left(mol\right)\)
Đúng 1
Bình luận (1)
Cho 4,8 gam khí oxi (oxygen)
a. Tính số mol của O2
b. Tính số phân tử O2
c. Phải lấy bao nhiêu gam Kẽm (Zinc) để có số nguyên tử bằng số phân tử có trong 4,8 g O2
( Zn = 65 , O = 16 )
a: \(n_{O_2}=\dfrac{4.8}{32}=0.15\left(mol\right)\)
Đúng 1
Bình luận (1)
\(a,n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{4,8}{32}=0,15\left(mol\right)\\ b,Số.phân.tử=n.6.10^{23}=0,15.6.10^{23}=9.10^{22}\left(p.tử\right)\)
c) Số nguyên tử Zn = Số phân tử O2
=> \(n_{Zn}=n_{O_2}=0,15\left(mol\right)\)
=> \(m_{Zn}=0,15.65=9,75\left(g\right)\)
Đúng 1
Bình luận (0)
Câu 3: Cho 4,8 gam khí oxi (oxygen)
a. Tính số mol của O2
b. Tính số phân tử O2
c. Phải lấy bao nhiêu gam Kẽm (Zinc) để có số nguyên tử bằng số phân tử có trong 4,8 g O2
( Zn = 65 , O = 16 )
a) \(n_{O_2}=\dfrac{m}{M}=\dfrac{4.8}{32}=0,15\left(mol\right)\)
b) \(0,15.6.10^{23}=0,9.10^{23}\)
Đúng 0
Bình luận (0)
a,\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
b, Số phân tử O2\(=n.6.10^{23}=0,15.6.10^{23}=9.10^{22}\)
Đúng 1
Bình luận (0)
cho kẽm tác dụng với axit clohidric sinh ra kẽm clorua và 3,36 lít khí hidro ở điều kiện tiêu chuẩn . a) Tính số nguyên tử kẽm đã phản ứng . b) Tính khối lượng kẽm clorua thu được. c) Lấy 1/2 lượng hidro thu được ở trên tác dụng với oxi dư, tính số gam nước được tạo thành
a) PTHH : Zn + 2 HCl -> ZnCl2 + H2
nH2= 0,15(mol)
-> nZn= nZnCl2=nH2= 0,15(mol)
-> Số nguyên tử kẽm p.ứ: 6.1023 .0,15= 9.1022 (nguyên tử)
b) mZnCl2= 136.0,15= 20,4(g)
c) H2+ 1/2 O2 -to-> H2O
nH2= 0,15/2= 0,075(mol)
-> nH2O= nH2= 0,075(mol)
-> mH2O= 0,075.18= 1,35(g)
Đúng 2
Bình luận (0)
Nguyên tử kẽm có bán kính r 1,35.10-1 nm, khối lượng nguyên tử là 65u. a) Tính khối lượng riêng của nguyên tử kẽm. b) Thực tế hầu như toàn bộ khối lượng nguyên tử tập trung ở hạt nhân với bán kính r 2.10-6nm. Tính khối lượng riêng của hạt nhân nguyên tử kẽm. Cho biết Vhình cầu 4/3 π.r3.
Đọc tiếp
Nguyên tử kẽm có bán kính r = 1,35.10-1 nm, khối lượng nguyên tử là 65u.
a) Tính khối lượng riêng của nguyên tử kẽm.
b) Thực tế hầu như toàn bộ khối lượng nguyên tử tập trung ở hạt nhân với bán kính r = 2.10-6nm. Tính khối lượng riêng của hạt nhân nguyên tử kẽm.
Cho biết Vhình cầu = 4/3 π.r3.
a) rZn = 1,35. 10-1 nm = 0,135.10-7 cm (1nm = 10-9m)
1u = 1,6600.10-24 g.
mZn = 65.1,6600.10-24 g = 107,9.10-24g.
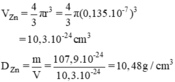
b) mhạt nhân Zn = 65u ⇒ 107,9.10-24 gam.
rhạt nhân Zn = 2.10-6nm = (2.10-6.10-7)cm = 2.10-13 cm.
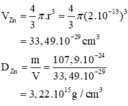
Đúng 0
Bình luận (0)
Hoà tan hết 6,5 gam Kẽm vào 150ml dung dịch axit sunfuric loãng (khối lượng riêng D= 1,08 g/ml)
a/ Tính thể tích khí thoát ra(đktc)?
b/ Tính nồng độ phần trăm của muối có trong dd sau phản ứng
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1......................0.1..........0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{dd_{H_2SO_4}}=150\cdot1.08=162\left(g\right)\)
\(m_{dd}=6.5+162-0.1\cdot2=168.3\left(g\right)\)
\(C\%_{ZnSO_4}=\dfrac{0.1\cdot161}{168.3}\cdot100\%=9.56\%\)
Đúng 2
Bình luận (4)
Câu 3: (2,0 điểm) Hòa tan hoàn toàn 52g kẽm vào dung dịch có chứa 58,4g axit clohidric (H và Cl) thu được x g muối kẽm clorua (Zn và Cl) khan và 17,92 lít khí hidro (đktc).
a. Lập PTHH và cho biết tỉ lệ số nguyên tử, phân tử giữa các chất trong phản ứng.
b. Viết công thức về khối lượng cho phản ứng trên và tính x.
a, PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
Số nguyên tử Zn + số phân tử HCl : Số phân tử ZnCl2 : số phân tử H2 = 1:2:1:1
b, \(m_{H_2}=\left(\dfrac{17,92}{22,4}\right).2=1,6g\)
Theo ĐLBTKL, ta có:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(\Rightarrow m_{ZnCl_2}=52+58,4-1,6=108,8g\)
Đúng 3
Bình luận (0)
Số nguyên tử kẽm trong 13 gam kẽm là:
A. 6. 1023. B. 12. 1023. C. 1,2. 1023. D. 1,8. 1023.



























