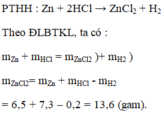cho 1 viên kẽm vào dung dịch axit clohidric HCl thi thay vien kem tan dan , dong thoi siu bot khi Hidro

Những câu hỏi liên quan
cho 1 viên kẽm vào axit clohidric HCl thi thay vien kem tan dần , dong thoi sui bot khi hidro
a) dau hieu nào cho thay có phan ung hóa hoc xay ra
b) Lap PTHH cho phan ứng trân , biết sản phẩm tạo thanh ngoai khi hidro còn có muoi kem clorua ZnnCl 2
a) Dấu hiệu : Viên kẽm tan dần và sủi bọt
b) \(Zn+2HCl\rightarrow H_2+ZnCl_2\)
Đúng 0
Bình luận (0)
a/ Dấu hiệu cho thấy có phản ứng xảy ra là viên kẽm đã tan dần, đồng thời có sủi bọt khí => Có biến đổi tính chất hóa học
b/PTHH: Zn +2HCl ===> ZnCl2 + H2
Đúng 0
Bình luận (0)
Cho 6.5 gam kẽm vào 200g dung dịch axit clohidric(HCl) thu được kẽm clorua(ZnCl2) và khí Hidro(H2)
a. TÍnh thể tích khí hidro(H2) thu được (ở đktc)
b Tính nồng độ phần trăm của dung dịch axit clohidric HCl đã dùng
Biết (H=1 ; Zn=65 ; Cl=35.5)
`Zn + 2HCl -> ZnCl_2 + H_2`
`0,1` `0,2` `0,1` `(mol)`
`n_[Zn]=[6,5]/65=0,1(mol)`
`a)V_[H_2]=0,1.22,4=2,24(l)`
`b)C%_[HCl]=[0,2.36,5]/200 . 100 =3,65%`
Đúng 4
Bình luận (3)
`Zn + HCl -> ZnCl_2 + H_2` `\uparrow`
`n_(Zn) = (6,5)/65 = 0,1 mol`.
`n_(H_2) = 0,1 mol`.
`V(H_2) = 0,1 xx 22,4 = 2,24l`.
`C%(HCl) = (0,2.36,5)/200 xx 100 = 36,5%`.
Đúng 3
Bình luận (2)
hoà tan hoàn toàn 6,5 kim loại kẽm zn vào dung dịch axit clohidric HCL 10%(vừa đủ) tính thể tích hidro thoát ra(đktc)
nZn = 6.5/65 = 0.1 (mol)
Zn + 2HCl =>ZnCl2 + H2
0.1..............................0.1
VH2 = 0.1 * 22.4 = 2.24 (l)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro,
Viết phản ứng hóa học xảy ra.
Tính khối lượng kẽm clorua Z n C l 2 tào thành.
Ghi Phương Trình Chữ . Thả 1 viên kẽm vào dung dịch axit clohidric thấy sủi bọt khí sinh ra, đó là khí hidro , còn lại trong dung dịch muối kẽm clorua.
,
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Kẽm + Axit clohidric => Kẽm clorua + Khí Hidro
Đúng 4
Bình luận (0)
Hòa tan hoàn toàn 6,5gam kẽm vào dung dịch axit clohidric(HCl) chứa 10,95gam HCl, thu được 0,2gam khí Hidro và muối kẽm Cl(ZnCl2)
a, Viết phương trình chữ của phản ứng trên
b, Viết biểu thức về khối lượq biết sau phản ứng axit HCl còn dư
c, Tính khối lượng muối kẽm Clorua thu được, biết lượng axit clohidric dư 3,65gam
a, Kẽm + axit clohidric → Khí hidro + muối kẽm
Đúng 0
Bình luận (0)
Nzn=0,1mol
a) có pt : Zn + 2Hcl -> ZnCl2 + H2
1 -> 2 -> 1 -> 1 mol
0,1-> 0,2 -> 0,1 -> o,1 mol
b) số Hcl đã dùng khi pứ là :
0,2 . 36,5= 7,3
-> số gam hcl dư là 10,95- 7,3=3,65(g)
c)mZnCl2=0,1 . 136=13,6g
Đúng 0
Bình luận (0)
Xác định chất tan, dung môi và dung dịch trong thí nghiệm sau:
Hòa tan viên kẽm vào dung dịch axit clohidric vừa đủ.
Chất tan là viên kẽm
Dung môi là axit clohidric
Dung dịch là hỗn hợn sau khi hòa tan
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl có chứa 7,3 gam HCl (vừa đủ). Sau phản ứng thu được dung dịch muối kẽm clorua và 0,2 gam khí hidro.
a) Lập công thức hóa học của muối kẽm clorua. Biết kẽm clorua do hai nguyên tố là Zn và Cl tạo ra.
b) Tính khối lượng muối kẽm clorua tạo thành.
a) Lập công thức hóa học của muối kẽm clorua: Z n C l 2
b) Khối lượng muối Z n C l 2 = 6,5 + 7,3 – 0,2 = 13,6 (gam)
Đúng 2
Bình luận (0)
Câu 3. Nêu hiện tượng quan sát được, viết PTHH xảy ra khi tiến hành thí nghiệm sau:
a.Cho dung dịch axit clohidric (HCl) vào ống nghiệm có chứa vài viên kẽm (Zn)
b.Cho từ từ dung dịch axit clohidric vào ống nghiệm có chứa một mảnh nhôm (Al)
a, b, Chung hiện tượng nhé:
Zn, Al tan trong dd HCl sủi bọt khí ko màu, ko mùi, ko vị, đó là H2
PTHH:
Zn + 2HCl -> ZnCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
Đúng 1
Bình luận (0)