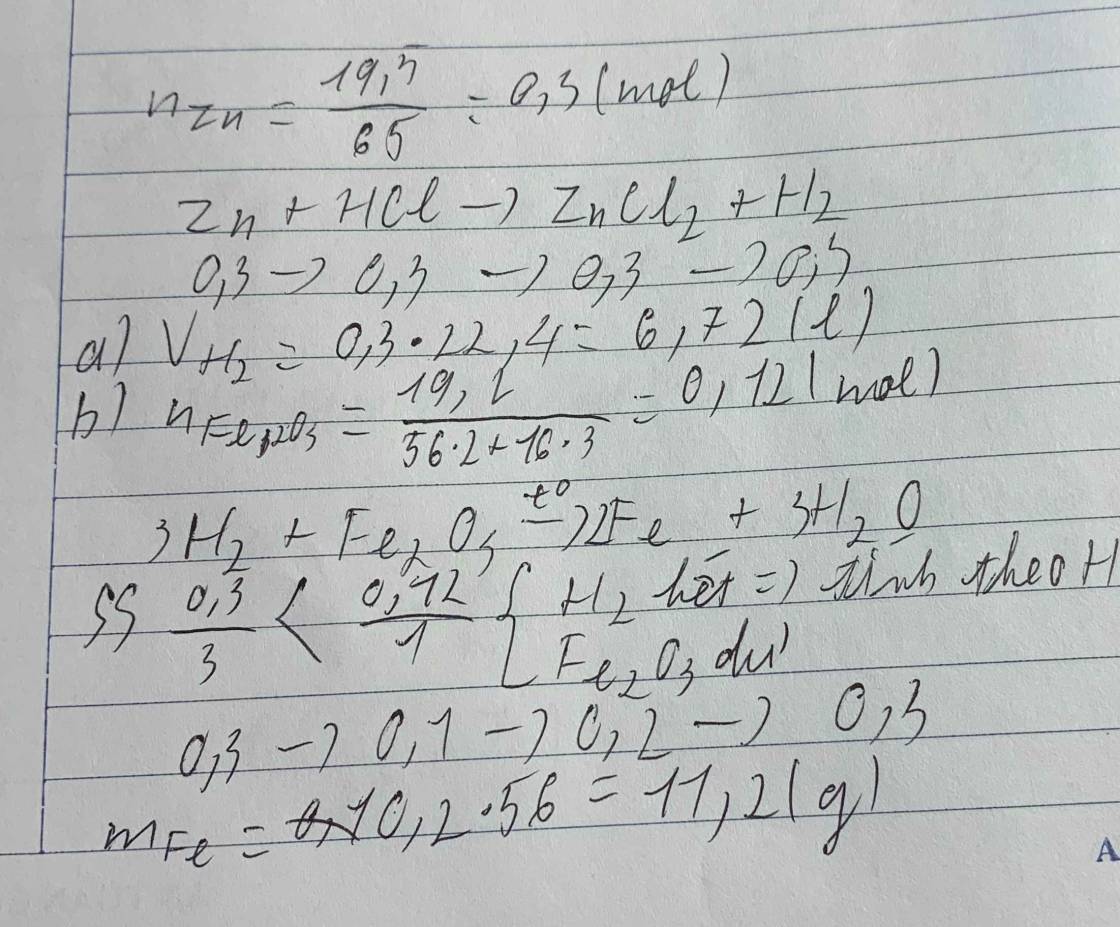Cho 4,8g Mg tác dụng vừa đủ với 100g dung dịch HCl. Hãy tính: a Thể tích H2 thoát ra ở đktc b Nồng độ % của dung dịch axit HCl đã dùng ( Cho biết O = 16;H = 1;Mg = 24;Cl = 35,5)
Bài 40: Dung dịch
a, Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow C\%_{HCl}=\dfrac{0,4.36,5}{100}.100\%=14,6\%\)
Đúng 2
Bình luận (0)
Để giải bài toán này, ta cần viết phương trình phản ứng giữa Mg và HCl:
$$\text{Mg} + 2\text{HCl} \rightarrow \text{MgCl}2 + \text{H}2$$
Theo đó, 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2. Ta có thể tính số mol Mg trong 4,8g Mg như sau:
$$n{\text{Mg}} = \frac{m{\text{Mg}}}{M_{\text{Mg}}} = \frac{4,8}{24} = 0,2 \text{mol}$$
Vì 1 mol Mg tác dụng với 2 mol HCl để tạo ra 1 mol H2, nên số mol HCl cần để tác dụng với 0,2 mol Mg là 0,4 mol. Từ đó, ta có thể tính khối lượng HCl cần dùng như sau:
$$m_{\text{HCl}} = n_{\text{HCl}} \times M_{\text{HCl}} = 0,4 \times 36,5 = 14,6 \text{g}$$
Vậy, dung dịch HCl có nồng độ $c = \frac{m_{\text{HCl}}}{V_{\text{HCl}}}$, trong đó $V_{\text{HCl}}$ là thể tích dung dịch HCl đã dùng. Để tính thể tích HCl đã dùng, ta cần biết nồng độ của dung dịch axit HCl đã dùng. Ta có thể tính nồng độ % của dung dịch axit HCl như sau:
$$\text{nồng độ %} = \frac{m_{\text{HCl}}}{m_{\text{dung dịch}}} \times 100%$$
Trong đó, $m_{\text{dung dịch}}$ là khối lượng của dung dịch HCl đã dùng. Từ đó, ta có thể tính được thể tích dung dịch HCl đã dùng và thể tích H2 thoát ra ở đktc như sau:
\begin{align*}
m_{\text{dung dịch}} &= \frac{m_{\text{HCl}}}{\text{nồng độ %}} = \frac{14,6}{36,5} \times 100% = 40\text{g} \
V_{\text{HCl}} &= \frac{m_{\text{HCl}}}{c_{\text{HCl}}} = \frac{14,6}{0,365} = 40\text{mL} \
V_{\text{H}2} &= n{\text{H}2} \times V{\text{m}} = 0,1 \times 24,45 = 2,445\text{L}
\end{align*}
Vậy, thể tích H2 thoát ra ở đktc là 2,445 L.
Đúng 1
Bình luận (1)
Hòa tan một kim loại Na vào nước sau phản ứng thu được 300ml dung dịch NaOH và 6,72l khí H2 ở (đktc) giúp mik với ((
Đọc tiếp
Hòa tan một kim loại Na vào nước sau phản ứng thu được 300ml dung dịch NaOH và 6,72l khí H2 ở (đktc)
giúp mik với =(( ![]()
![]()
![]()
a)\(PTHH:2Na+2H_2O\xrightarrow[]{}2NaOH+H_2\)
b)\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH : 2Na + 2H2O → 2NaOH + H2
tỉ lệ : 2 2 2 1 (mol)
số mol: 0,6 0,6 0,6 0,3(mol)
Đổi 300ml = 0,3l
Nồng độ phần trăm mol/l của dung dịch thu được là:
\(C_{MNaOH}=\dfrac{n_{NaOH}}{V_{dd}}=\dfrac{0,6}{0,3}=2\left(M\right)\)
c)Khối lượng của NaOH là
\(m_{NaOH}=n_{NaOH}.M_{NaOH}=0,6.40=24\left(g\right)\)
Cho nước vào 24g NaOH cho đến khi được 300ml thì dừng lạ, khuấy đều ta thu được 300ml dung dịch NaOH.
Đúng 1
Bình luận (0)
Xác định chất tan, dung môi và dung dịch trong thí nghiệm sau:
Hòa tan viên kẽm vào dung dịch axit clohidric vừa đủ.
Chất tan là viên kẽm
Dung môi là axit clohidric
Dung dịch là hỗn hợn sau khi hòa tan
Đúng 1
Bình luận (1)
Có 3 lọ mất nhãn ,mỗi lọ đựng một trong các dung dịch sau đây: Na2SO4 ,NaOH ,HCl. Bằng phương pháp hóa học em hãy nhận biết 3 dung dịch trên
-Trích mẫu thử mỗi lọ.
-Nhỏ vài giọt lên giấy quỳ tím.
+Lọ nào làm quỳ tím chuyển thành màu xanh là NaOH.
+Lọ nào làm quỳ tím chuyển thành màu đỏ là HCl.
+Lọ nào không làm quỳ tím đổi màu là Na2SO4.
-Dán nhãn mỗi lọ.
Đúng 2
Bình luận (0)
TRÍCH MẪU THỬ VÀ ĐÁNH SỐ THỨ TỰ:
- CHO QUỲ TÍM VÀO TỪNG MẪU THỬ:
+ QUỲ TÍM CHUYỂN SANG MÀU ĐỎ
=> DD HCl + QUÝ TÍM CHUYỂN MÀU XANH
=> DD NaOH
+ QUỲ TÍM KO CHUYỂN MÀU
=>Na2SO4
Đúng 0
Bình luận (0)
Hòa tan hết 9,3g Na2O trong nước tạo thành dung dịch A. a. Dung dịch A là dung dịch gì? Chất tan trong dung dịch A là chất nào? b. Tính khối lượng sản phẩm tạo thành sau phản ứng. c. Dung dịch sau phản ứng làm quỳ tím đổi thành màu gì?
a) Dung dich A là dung dịch NaOH.
Chất tan của dung dịch A là Na2O.
b)\(n_{Na_2O}=\dfrac{9,3}{62}=0,15\left(mol\right)\)
\(PTHH:Na_2O+H_2O\xrightarrow[]{}2NaOH\)
\(n_{NaOH}=\dfrac{0,15.2}{1}=0,3\left(mol\right)\)
\(m_{NaOH}=0,3.40=12\left(g\right)\)
c)Dung dịch sau phản ứng làm quỳ tím đổi thành màu xanh.
Đúng 2
Bình luận (0)
Cho 19,5 g kẽm tác dụng hết với dung dịch axit clohiđric. a. Tính thể tích khí H2 sinh ra (ở đktc). b. Nếu dùng thể tích H2 trên để khử 19,2 g sắt (III) oxit ở nhiệt độ cao thì thu được bao nhiêu gam sắt
tính nồng độ mol của dd khi pha 20 gam naoh vào được 2l dung dịch hóa học
Câu 1: Ở 25 độ C, khi hòa tan 20 gam NaCI vào 40 gam nước thì thấy có 5,6 gam NaCI không tan được nữa. Tính độ tan của NaCI ở nhiệt độ trênCâu 2: Tính nồng độ phần trăm của dung dịch Al2(SO4)3, biết trong 2,5kg dung dịch có hòa tan hết 34,2 gam AI2 (SO4)3?Câu 3: Tính nồng độ mol của dung dịch CuSO4, biết trong 4 lít dung dịch có hòa tan hết 400 gam CuSO4?Câu 4: Trong phòng thí nghiệm có sẵn một dung dịch NaCI và các dụng cụ, thiết bị có sẵn. Em hãy trình bày cách xác định dung dịch NaCI này là b...
Đọc tiếp
Câu 1: Ở 25 độ C, khi hòa tan 20 gam NaCI vào 40 gam nước thì thấy có 5,6 gam NaCI không tan được nữa. Tính độ tan của NaCI ở nhiệt độ trên
Câu 2: Tính nồng độ phần trăm của dung dịch Al2(SO4)3, biết trong 2,5kg dung dịch có hòa tan hết 34,2 gam AI2 (SO4)3?
Câu 3: Tính nồng độ mol của dung dịch CuSO4, biết trong 4 lít dung dịch có hòa tan hết 400 gam CuSO4?
Câu 4: Trong phòng thí nghiệm có sẵn một dung dịch NaCI và các dụng cụ, thiết bị có sẵn. Em hãy trình bày cách xác định dung dịch NaCI này là bão hòa hay chưa bão hòa
Câu 1 : Độ tan của NaCl ở 25 độ C :
\(S=\dfrac{\left(20-5,6\right)}{40}.100=36\left(g\right)\)
Câu 2 :
Đổi 2,5 kg = 2500(g)
Nồng độ % của Al2(SO4)3 là :
\(C\%=\dfrac{34,2}{2500}.100\%=1,368\%\)
Câu 3 :
\(n_{CuSO_4}=\dfrac{400}{160}=2,5\left(mol\right)\)
\(C_{M\left(CuSO_4\right)}=\dfrac{2,5}{4}=0,625M\)
Câu 4 :
Muốn xác định 1 dd đã bão hòa chưa thì cần biết dd có hòa tan được thêm chất tan không. Vậy ta cần thêm NaCl và dd và quậy đều, nếu bột NaCl tan tức là dd chưa bão hòa, nếu bột NaCl không tan tức là dd đã bão hòa.
Đúng 1
Bình luận (0)
Chỉ ra chất tan, dung môi, dung dịch sau:a. Trộn 5 gam muối ăn với 100 gam nước thu được dung dịch nước muối.b. Trộn 15 gam kali hidroxit vào 250 gam nước thu được dung dịch kali hidroxit.c. Trộn 20 gam axit clohidric vào 550 gam nước thu được dung dịch axit clohidric.
Đọc tiếp
Chỉ ra chất tan, dung môi, dung dịch sau:
a. Trộn 5 gam muối ăn với 100 gam nước thu được dung dịch nước muối.
b. Trộn 15 gam kali hidroxit vào 250 gam nước thu được dung dịch kali hidroxit.
c. Trộn 20 gam axit clohidric vào 550 gam nước thu được dung dịch axit clohidric.
a, Do không xảy ra p/ư nên chất tan vẫn là muối (NaCl ) , dung môi là nước , dd sau p/ư là dd nước muối (NaCl )
b, chất tan là KOH , dung môi là nước , dd là dd KOH sau p/ư
c, chất tan là HCl , dung môi là nước , dd sau p/ư là dd HCl
Đúng 2
Bình luận (1)
cho 4,8g Mg tác dụng với dung dịch HCl 10% a) tính khối lượng dung dịch axit cần dùng b) tính khối lượng muối và thể tích khí bay ra c) tính nồng độ phần trăm của muối tạo ra thành sau phản ứng
a)\(m_{ddHCl}=\dfrac{4,8}{10\%}.100\%=48\left(g\right)\)
b)\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
\(PTHH:Mg+2HCl\xrightarrow[]{}MgCl_2+H_2\)
\(n_{MgCl_2}=n_{Mg}=n_{H_2}=0,2\)
\(m_{MgCl_2}=0,2.95=19\left(g\right)\)
\(V_{H_2}=0,2.22,4=4.48\left(l\right)\)
c)\(m_{H_2}=0,2.2=0,4\left(g\right)\)
\(m_{ddMgCl_2}=4,8+48-0,4=52,4\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{19}{52,4}.100\%=36\%\)
Đúng 1
Bình luận (11)