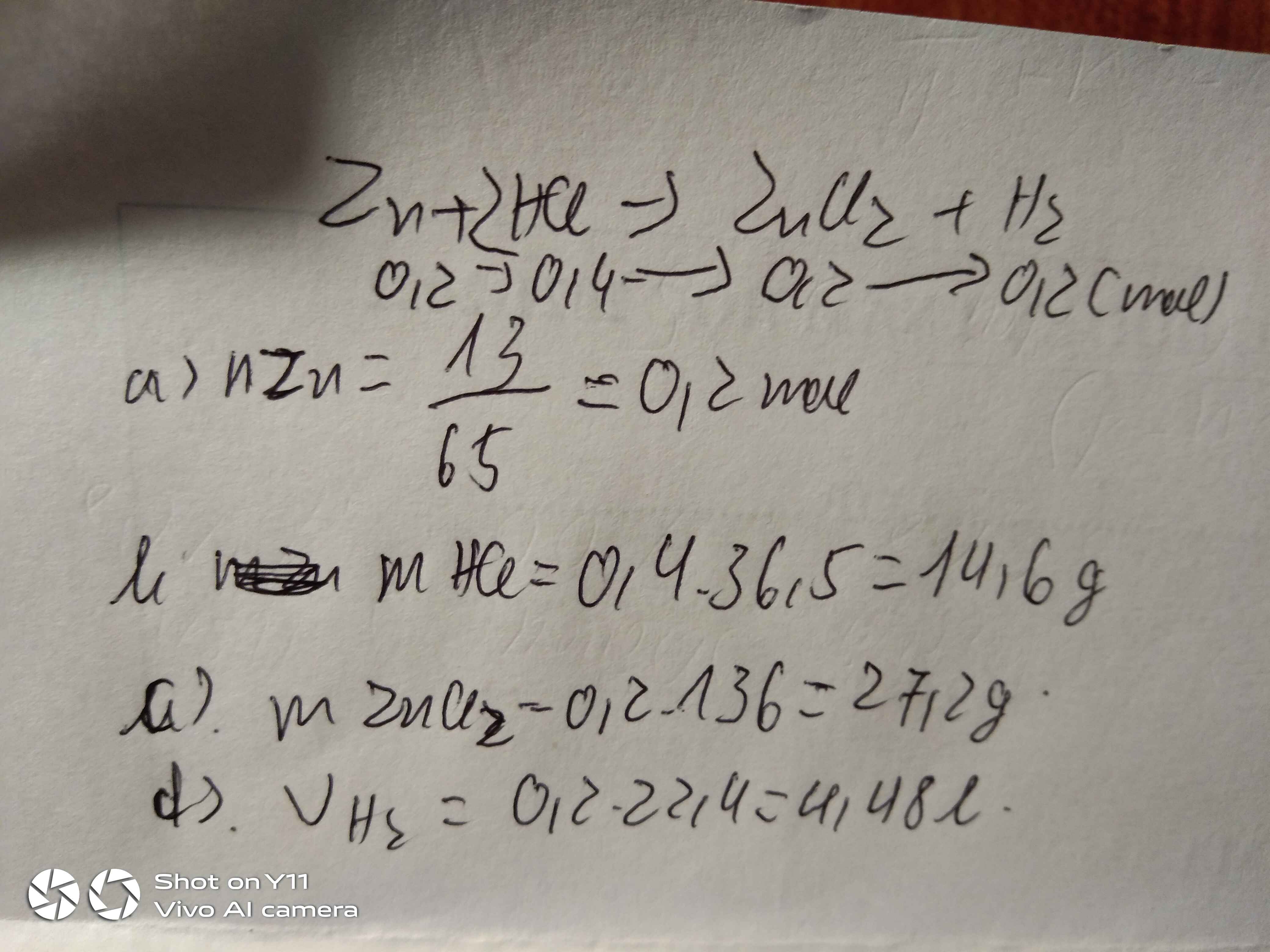Câu 1: Cho 16,25 gam kẽm tác dụng với một lượng vừa đủ dd HCl 10% a. Viết PTHH của phản ứng.
b. Tính thể tích khí hydrogen thu được ở điều kiện chuẩn.
c. Tính khối lượng dd HCl 10% cần dùng.
d. Tính nồng độ phần trăm của dung dịch thu được sau phản ứng.
Câu 2: Hòa tan hoàn toàn 40 gam NaOH bằng dung dịch H2SO4 2 M tạo thành muối Na2SO4 và nước.
a. Viết PTHH của phản ứng
c. Tính thể tích dung dịch H2SO4 2 M đã dùng.
d. Tính CM của dung dịch Na2SO4 sau phản ứng. (Coi thể tích dung dịch kh ng thay đổi).