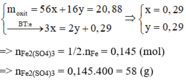Những câu hỏi liên quan
Câu 1. Cho 11,2 gam sắt vào dung dịch chứa 14,7 gam axit sunfuric H2SO4, sau phản ứng thu được m gam muối sắt (II) sunfat FeSO4 và V lít khí hiđro (đktc).a. Tính giá trị của m và V.b. Tính khối lượng chất còn dưCâu 2. Đốt cháy hoàn toàn 12,4 gam photpho trong bình chứa 13,44 lít khí oxi (đktc) tạo ra chất rắn màu trắng điphotpho pentaoxit (P2O5).a. Cho biết sau phản ứng, chất nào còn dư?b. Tính khối lượng sản phẩm tạo thành?
Đọc tiếp
Câu 1. Cho 11,2 gam sắt vào dung dịch chứa 14,7 gam axit sunfuric H2SO4, sau phản ứng thu được m gam muối sắt (II) sunfat FeSO4 và V lít khí hiđro (đktc).
a. Tính giá trị của m và V.
b. Tính khối lượng chất còn dư
Câu 2. Đốt cháy hoàn toàn 12,4 gam photpho trong bình chứa 13,44 lít khí oxi (đktc) tạo ra chất rắn màu trắng điphotpho pentaoxit (P2O5).
a. Cho biết sau phản ứng, chất nào còn dư?
b. Tính khối lượng sản phẩm tạo thành?
1a. PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{14,7}{1.2+32+16.4}=0,15\left(mol\right)\)
Do \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) => Fe dư, H2SO4 hết.
- Theo PTHH \(\Rightarrow n_{H_2SO_4}=n_{FeSO_4}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{FeSO_4}=0,15.152=22,8\left(g\right)\\V_{H_2}=0,15.22,4=3,36\left(l\right)\end{matrix}\right.\)
Đúng 4
Bình luận (0)
Cho 11,2 gam sắt tác dụng với 50ml dung dịch axít sunfuric thu được muối sắt (II) sunfat và khí hidro a) viết phương trình hóa học đã xảy ra b) tính khối lượng muối thu được sau phản ứng c) tính nồng độ mol của dung dịch h2so4 đã dùng
Sửa đề : 11.2 g sắt
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.2....0.2.................0.2\)
\(m_{FeSO_4}=0.2\cdot152=30.4\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2}{0.05}=4\left(M\right)\)
Đúng 2
Bình luận (1)
\(m_{Fe}=\dfrac{11}{56}=0.19\left(mol\right)\)
\(Fe+H_2SO_4->FeSO_4+H_2\)
0.19 0.19 0.19 (mol)
\(m_{FeSO_4}=0.19\cdot152=28.28\left(g\right)\)
\(Cm=\dfrac{0.19}{0.05}=3.8M\)
Đúng 0
Bình luận (1)
PTHH:Fe+H2SO4→FeSO4+H2Fe+H2SO4→FeSO4+H2
TPT: 1 1 1 1 1 1 1 MOL
TĐ: 0,2 0,2 0,20 2 0,2 0,2 0,2 MOL
nFe=11.256=0.2(mol)
mFeSO4=0,2⋅152=30,4(g)
Đúng 0
Bình luận (0)
Hòa tan vừa đủ 1,3g kẽm bằng dung dịch axit H2SO4 10%. Sau khi phản ứng kết thúc thu đc muối magie sùmat và khí hidro
a. Viết PTHH
b. Tính khối lượng muối kẽm sunfat sinh ra
c. TÍnh thể tích khí hidro thoát ra ở đktc
d. Tính khối lượng dung dịch ãit đã tham gia phản ứng
e. Tính nồng độ phần trăm của dung dịch muối tạo thành
\(a,n_{Zn}=\dfrac{1,3}{65}=0,02\left(mol\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
0,02--->0,02--------->0,02----->0,02
b, mZnSO4 = 0,02.161 = 3,22 (g)
c, VH2 = 0,02.22,4 = 0,448 (l)
d, \(m_{ddH_2SO_4}=\dfrac{0,02.98}{10\%}=19,6\left(g\right)\)
e, mdd = 19,6 + 1,3 - 0,02.2 = 20,86 (g)
=> \(C\%_{ZnSO_4}=\dfrac{0,02.161}{20,86}.100\%=15,44\%\)
Đúng 1
Bình luận (0)
Hòa tan 19,6 gam Sắt vào dung dịch axit sunfuric H2 SO4 loãng thu được muối sắt(II) sunfat FeSO4 và khí hiđro.
$n_{Fe}=\frac{19,6}{56}=0,35(mol)$
$Fe+H_2SO_4\to FeSO_4+H_2$
Theo PT: $n_{H_2SO_4}=n_{FeSO_4}=n_{H_2}=0,35(mol)$
$\to m_{H_2SO_4}=0,35.98=34,3(g)$
$m_{FeSO_4}=0,35.152=53,2(g)$
$m_{H_2}=0,35.2=0,7(g)$
Đúng 1
Bình luận (0)
Dùng 500 ml dung dịch H2SO4 1,2 m để hoà tan hết lượng kim loại sắt. Phản ứng tạo thành sắt (II) sunfat và khí hiđro: a) Viết phương trình hoá học của phản ứng? b) Tính khối lượng muối sắt (II) sunfat thu được? c) Tính thể tích khí H2 thoát ra (Ở ĐKTC)? d) Dẫn toàn bộ khí H2 thu được ở trên qua bột CuO đun nóng. Tính khối lượng điều chế được?
Đọc tiếp
Dùng 500 ml dung dịch H2SO4 1,2 m để hoà tan hết lượng kim loại sắt. Phản ứng tạo thành sắt (II) sunfat và khí hiđro: a) Viết phương trình hoá học của phản ứng? b) Tính khối lượng muối sắt (II) sunfat thu được? c) Tính thể tích khí H2 thoát ra (Ở ĐKTC)? d) Dẫn toàn bộ khí H2 thu được ở trên qua bột CuO đun nóng. Tính khối lượng điều chế được?
a) PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b) \(n_{H_2SO_4}=C_MV=1,2\cdot0,5=0,6\left(mol\right)\)
PTHH : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,6 0,6 0,6
\(\Rightarrow m_{FeSO_4}=n_{FeSO_4}M_{FeSO_4}=0,6\cdot152=91,2\left(g\right)\)
c) Từ câu b \(\Rightarrow n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow V_{H_2}=n_{H_2}.22,4=0,6\cdot22,4=13,44\left(l\right)\)
d) PTHH : \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6
\(\Rightarrow m_{Cu}=n_{Cu}M_{Cu}=0,6\cdot64=38,4\left(g\right)\)
Đúng 2
Bình luận (0)
a)\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
b)Đổi 500ml = 0,5l
Số mol của H2SO4 là:
\(C_{MH_2SO_4}=\dfrac{n_{H_2SO_4}}{V_{H_2SO_{\text{4 }}}}\Rightarrow n_{H_2SO_4}=C_{MH_2SO_4}.V_{H_2SO_4}=1,2.0,5=0,6\left(mol\right)\)
\(PTHH:Fe+H_2SO_4\xrightarrow[]{}FeSO_4+H_2\)
Tỉ lệ : 1 1 1 1 (mol)
Số mol : 0,6 0,6 0,6 0,6(mol)
Khối lượng sắt(II)sunfat thu được là:
\(m_{FeSO_4}=n_{FeSO_4}.M_{FeSO_{\text{4 }}}=0,6.152=91,2\left(g\right)\)
c) Thể tích khí H2 thoát ra là:
\(V_{H_2}=n_{H_2}.22,4=0,6.22,4=13,44\left(l\right)\)
d)\(PTHH:CuO+H_2\xrightarrow[]{t^0}Cu+H_2O\)
tỉ lệ :1 1 1 1 (mol)
số mol :0,6 0,6 0,6 0,6 (mol)
Khối lượng CuO điều chế được là:
\(m_{CuO}=n_{CuO}.M_{CuO}=0,6.80=48\left(g\right)\)
Đúng 1
Bình luận (2)
14: Dùng 300ml dung dịch H2SO4 0,6M để hòa tan hết lượng kim loại sắt, phản ứng tạo thành Sắt (II) sunfat và khí hidro.
a,Viết PTHH của phản ứng
b,Tính khối lượng sắt (II) sunfat thu được
c,Tính thể tích khí H2 thoát ra (ở đktc)?
a) Fe + H2SO4 --> FeSO4 + H2
b)
\(n_{H_2SO_4}=0,3.0,6=0,18\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,18<--0,18---->0,18-->0,18
=> \(m_{FeSO_4}=0,18.152=27,36\left(g\right)\)
c) VH2 = 0,18.22,4 = 4,032 (l)
Đúng 5
Bình luận (1)
`a)PTHH:`
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,18` `0,18` `0,18` `(mol)`
`n_[H_2 SO_4]=0,6.0,3=0,18(mol)`
`b)m_[FeSO_4]=0,18.152=27,36(g)`
`c)V_[H_2]=0,18.22,4=4,032(l)`
Đúng 3
Bình luận (0)
Cho 22,4 gam sắt vào dung dịch axit clohidric Hcl dư, sau phản ứng thu được muối FeCl2 và 6,72 lít khí hidro ở đktc
a) Viết PTHH
b) Tính khối lượng sắt tham gia phản ứng
c)Tính khối lượng muối FeCl2 tạo thành sau phản ứng
\(a)\\ Fe + 2HCl \to FeCl_2 + H_2\)
b)
\(n_{Fe} = \dfrac{22,4}{56}= 0,4(mol)\\ n_{H_2} = \dfrac{6,72}{22,4} = 0,3(mol)\)
Ta thấy : \(n_{Fe} > n_{H_2}\) nên Fe dư.
Theo PTHH :
\(n_{Fe\ pư} = n_{H_2} = 0,3(mol)\\ \Rightarrow m_{Fe\ pư} = 0,3.56 = 16,8(gam)\)
c)
Ta có :
\(n_{FeCl_2} = n_{H_2} = 0,3(mol)\\ \Rightarrow m_{FeCl_2} = 0,3.127 = 38,1(gam)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là A. 58,0 B. 54,0. C. 52,2. D. 48,4.
Đọc tiếp
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0
B. 54,0.
C. 52,2.
D. 48,4.
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là A. 58,0. B. 54,0. C. 52,2. D. 48,4.
Đọc tiếp
Hòa tan hoàn toàn 20,88 gam một oxit sắt bằng dung dịch H2SO4 đặc, nóng thu được dung dịch X và 3,248 lít khí SO2 ( sản phẩm khử duy nhất, ở đktc). Cô cạn dung dịch X, thu được m gam muối sunfat khan. Giá trị của m là
A. 58,0.
B. 54,0.
C. 52,2.
D. 48,4.