Đốt cháy 9,2 gam Na trong bình chứa 1,12 lít O2 ở điều kiện tiêu chuẩn thu được chất rắn A. a,hỏi sau phản ứng chất nào còn dư ?Dư bảo nhiêu gam b, tính phần trăm mỗi chất có trong A

Những câu hỏi liên quan
Đốt cháy 9,2 Na trong bình chứa 1,12 lít O2 ở điều kiện tiêu chuẩn thu được chất rắn A a,Hỏi sau phản ứng chất nào dư? Dư bao nhiêu gam b, Tính phần trăm mỗi chất có trong A?
a: \(n_{Na}=\dfrac{9.2}{23}=0.4\left(mol\right)\)
\(n_{O_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
=>Na dư 0,35 mol
b: \(4Na+O_2\rightarrow2Na_2O\)
Đúng 1
Bình luận (0)
a: nNa=9.223=0.4(mol)nNa=9.223=0.4(mol)
nO2=1.1222.4=0.05(mol)nO2=1.1222.4=0.05(mol)
=>Na dư 0,35 mol
b: 4Na+O2→2Na2O4Na+O2→2Na2O
Đúng 0
Bình luận (0)
Đốt cháy 9,2 gam trong bình chứa 1,12 lít O2 ở điều kiện tiêu chuẩn thu được chất rắn A A/hỏi sau phản ứng chất nào còn dư ?Dư bao nhiêu gam? B/tính phần trăm mỗi chất trong A
Câu 4. Đốt cháy 6,2 gam photpho trong bình chứa 7,84 lít khí oxi ở điều kiện tiêu chuẩn
a/ Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b/ Tính khối lượng sản phẩm tạo thành sau phản ứng.
nP=\(\dfrac{62}{31}\)=0,2(mol)
nO2=\(\dfrac{7,84}{22,4}\)=0,35(mol)
PTHH:4P+5O2to→2P2O5
tpứ: 0,2 0,35
pứ: 0,2 0,25 0,1
spứ: 0 0,1 0,1
a)chất còn dư là oxi
mO2dư=0,1.32=3,2(g)
b)mP2O5=n.M=0,1.142=14,2(g)
Đúng 1
Bình luận (0)
\(a.n_P=0,2\left(mol\right);n_{O_2}=0,35\left(mol\right)\\ 4P+5O_2-^{t^o}\rightarrow2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,35}{5}\\ \Rightarrow SauphảnứngO_2dư\\ n_{O_2\left(pứ\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\\ \Rightarrow m_{P\left(dư\right)}=\left(0,35-0,25\right).32=3,2\left(g\right)\\ b.n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\\ \Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
Đúng 0
Bình luận (0)
a) n\(_P\) = \(\dfrac{6,2}{31}\) = 0,2(mol); n\(_{O_2}\) = \(\dfrac{7,84}{22,4}\) = 0,35(mol).
Theo phương trình hóa học:
\(4P+5O_2\) \(\underrightarrow{t^o}\) \(2P_2O_5\)
4 5 2 (mol)
0,2 \(\rightarrow\)0,25 \(\rightarrow\) 0,1(mol)
Tỉ lệ số mol: \(\dfrac{0,2}{4}< \dfrac{0,35}{5}\) \(\Rightarrow\) \(O_2\) phản ứng dư, P phản ứng hết.
\(n_{O_2}\)dư = 0,35 - \(\dfrac{0,2.5}{4}\) = 0,1(mol) \(\Rightarrow\) \(m_{O_2}\)dư = 0,1.32 = 3,2g
b) \(n_{P_2O_5}\) = 0,1.142 = 14,2g
Đúng 0
Bình luận (0)
Đốt 9,2 g Na trong bình chứa 4480 ml oxi(điều kiện chuẩn )Hỏi sau phản ứng chất nào dư? dư bao nhiêu gam?
4Na + O2 -> 2Na2O
nNa = 9,2/23= 0,4 ( mol )
nNa/4=0,4/4=0,1
nO2/1>nNa/4(0,2>0,1)
Nên : O2 dư
nO2phản ứng = nNa *
Đúng 1
Bình luận (0)
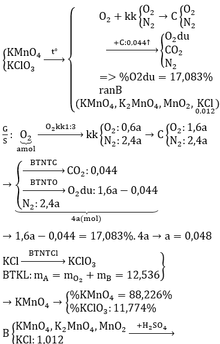
Nung m gam hỗn hợp A gồm KMnO4 và KClO3 thu được chất rắn B và khí O2. Lúc đó KClO3 phân hủy hoàn toàn, còn KMnO4 phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132% khối lượng. Trộn lượng O2 thu được ở trên với không khí (có phần trăm thể tích: 20% O2; 80% N2) theo tỉ lệ thể tích tương ứng là 1:3 tạo thành hỗn hợp khí C. Cho toàn bộ khí C vào bình chứa 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí D gồm 3 khí trong đó O2 chiếm 17,083% về thể tích. a) Tính phần trăm k...
Đọc tiếp
Nung m gam hỗn hợp A gồm KMnO4 và KClO3 thu được chất rắn B và khí O2. Lúc đó KClO3 phân hủy hoàn toàn, còn KMnO4 phân hủy không hoàn toàn. Trong B có 0,894 gam KCl chiếm 8,132% khối lượng. Trộn lượng O2 thu được ở trên với không khí (có phần trăm thể tích: 20% O2; 80% N2) theo tỉ lệ thể tích tương ứng là 1:3 tạo thành hỗn hợp khí C. Cho toàn bộ khí C vào bình chứa 0,528 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí D gồm 3 khí trong đó O2 chiếm 17,083% về thể tích.
a) Tính phần trăm khối lượng mỗi chất có trong A.
b) Thêm 74,5 gam KCl vào chất rắn B được hỗn hợp E. Cho E vào dung dịch H2SO4 loãng dư, đun nóng nhẹ cho đến phản ứng hoàn toàn. Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn.
Đốt cháy 2,8g Fe trong bình chứa 22,4 khí O2 ở điều kiện tiêu chuẩn , thu được Fe3O4 a/ viết pthh b / cho biết chất nào dư sau phản ứng bao nhiêu g? c/ tính mFe3O4 thu được (Fe=56,O=16)
Xem chi tiết
nFe = 2.8/56 = 0.05 (mol)
nO2 = 22.4 / 22.4 = 1 (mol)
3Fe + 2O2 -to-> Fe3O4
0.05__1/30______1/60
mO2 (dư) = ( 1 - 1/30) * 32 = 30.93 (g)
mFe3O4 = 1/60 * 232 = 3.867 (g)
Đúng 3
Bình luận (0)
a/ \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
b/ Ta có: \(n_{Fe}=\dfrac{2.8}{56}=0.05\left(mol\right)\)
\(n_{O_2}=\dfrac{22.4}{22.4}=1\left(mol\right)\)
Ta có: \(\dfrac{n_{Fe\left(bra\right)}}{n_{Fe\left(pt\right)}}=\dfrac{0.05}{3}=0.016< \dfrac{n_{O_2\left(bra\right)}}{n_{O_2\left(pt\right)}}=\dfrac{1}{2}=0.5\)
=> Oxi phản ứng dư
mO2 dư = (1 - 1/30) . 32 = 30.93 (g)
mFe3O4 = 1/60 . 232 = 3.867 (g)
Đúng 1
Bình luận (0)
a) 3Fe + 2O2 t o Fe3O4
b) nFe = \(\dfrac{2,8}{56}\)= 0,05 (mol)
nO2= \(\dfrac{22,4}{22,4}\)= 1 (mol)
3Fe +2 O2 toFe3O4
\(\dfrac{3Fe}{2O_2}=\dfrac{0,05}{1}\Leftrightarrow\dfrac{Fe}{O_2}=\dfrac{0,1}{3}\)Vậy O2 dư
3Fe +2 O2 toFe3O4
(mol) 0,05-> \(\dfrac{1}{30}\)-------> \(\dfrac{1}{60}\)
mO2dư= (1-\(\dfrac{1}{30}\)). 32 = 30,93 (g)
c) mFe3O4=\(\dfrac{1}{60}\) . 232 = 3,87 (g)
Đúng 2
Bình luận (0)
Đốt cháy 11,2 gam sắt trong 12,8 gam oxi sau phản ứng thu được sản phẩm là oxit sắt từ Fe3O4 Sau phản ứng chất nào còn dư và dư bao nhiêu mol? Tính khối lượng sản phẩm thu được Tính V không khí cần dùng ở điều kiện tiêu chuẩn? Biết O2 chiếm 1/5 thể tích không khí
PTHH: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{3}< \dfrac{0,4}{2}\) \(\Rightarrow\) Oxi còn dư, Fe p/ứ hết
\(\Rightarrow n_{O_2\left(dư\right)}=0,4-\dfrac{2}{15}=\dfrac{4}{15}\left(mol\right)\)
+) Theo PTHH: \(\left\{{}\begin{matrix}n_{O_2}=\dfrac{2}{15}\left(mol\right)\\n_{Fe_3O_4}=\dfrac{1}{15}\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{kk}=\dfrac{2}{15}\cdot22,4\cdot5\approx14,93\left(l\right)\\m_{Fe_3O_4}=\dfrac{1}{15}\cdot232\approx15,47\left(g\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
3. Đốt cháy 4,8 gam magie trong 3,36 lít khí Oxi ở điều kiện tiêu chuẩn.a. Chất nào còn dư sau phản ứng và dư bao nhiêu gam (lit - đktc)?b. Tính khối lượng sản phẩm thu được
a)
\(n_{Mg} = \dfrac{4,8}{24} = 0,2(mol)\\ n_{O_2} = \dfrac{3,36}{22,4}= 0,15(mol)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\)
Ta thấy :
\( \dfrac{n_{Mg}}{2} = 0,1 < n_{O_2} = 0,15 \) nên O2 dư.
\(n_{O_2\ pư} = \dfrac{n_{Mg}}{2} = 0,1(mol)\\ m_{O_2\ dư} = (0,15-0,1).32 = 1,6(gam)\\ V_{O_2\ dư} = (0,15-0,1).22,4 = 1,12(lít)\)
b)
\(n_{MgO} = n_{Mg} = 0,2\ mol\\ \Rightarrow m_{MgO} = 0,2.40 = 8\ gam\)
Đúng 1
Bình luận (0)
đốt cháy hoàn toàn 16.8 gam sắt trong bình chứa 3,36l oxy trong điều kiện tiêu chuẩn. Sau phản ứng sắt hay oxy còn dư , tính khối lượng chất còn dư, tính khối lượng sản phẩm thu được?
TH1: Nếu sản phẩm là Fe2O3.
2Fe + 3/2O2 ---> Fe2O3
nFe = 16,8/56 = 0,3 mol; nO2 = 3,36/22,4 = 0,15 mol.
Theo p.ư trên thì nFe = 4/3nO2 = 0,2 mol. Do đó: Fe dư 0,1 mol; mFe dư = 5,6 g; mFe2O3 = 160.0,1 = 16g.
TH2: Nếu sản phẩm là FeO:
Fe + 1/2O2 ---> FeO
nFe = 2nO2 = 0,3 mol. Vì vậy cả 2 chất đều hết. mFeO = 0,3.72 = 22,6 g.
TH3: Nếu sản phẩm là Fe3O4.
3Fe + 2O2 ---> Fe3O4
nFe = 3/2nO2 = 0,225 mol. Do đó: Fe dư 0,3 - 0,225 = 0,075 mol.
mFe dư = 56.0,075 = 4,2 g; mFe3O4 = 232.0,075 = 17,4 g.
Đúng 0
Bình luận (0)