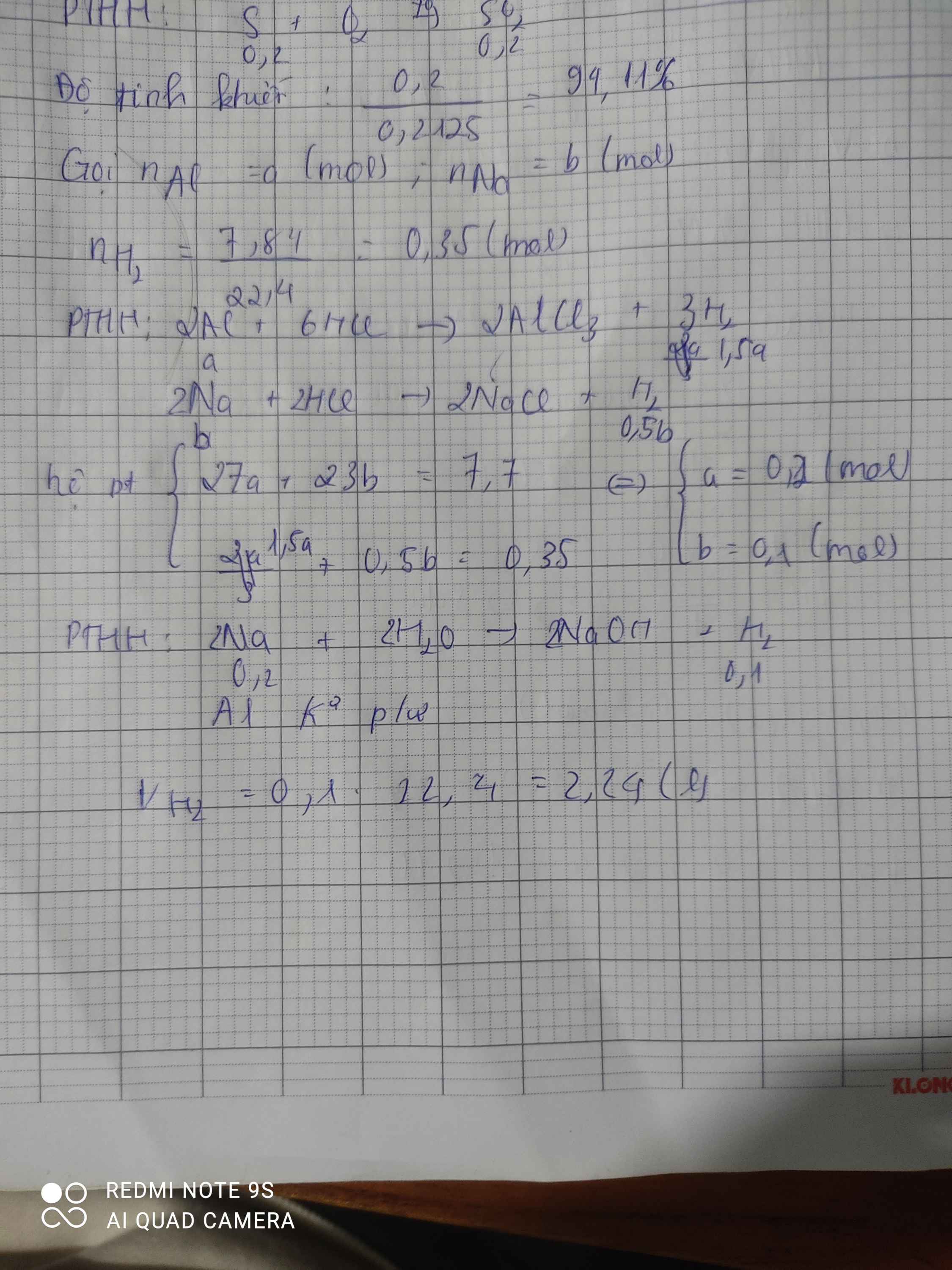cho hòa tan 3,9g vào nước .Tính khi H2 (đktc) thoát ra

Những câu hỏi liên quan
cho hòa tan 3,9g kali vào nước . tính thể tích H2 thoát ra
\(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\\
pthh:K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
0,1 0,05
\(V_{H_2}=0,05.22,4=1,12l\)
Đúng 5
Bình luận (0)
`2K + 2H_2 O -> 2KOH + H_2`
`0,1` `0,05` `(mol)`
`n_K=[3,9]/39=0,1(mol)`
`=>V_[H_2]=0,05.22,4=1,12(l)`
Đúng 5
Bình luận (0)
Ta có phương trình: `2K + 2H_2O -> 2KOH + 2H_2 \uparrow`.
`=>` `n_K = (3,9)/39 = 0,1 mol`.
`=>` `n_(H_2) = 0,1 xx 1 : 2 = 0,05 mol`.
`=>` `V_(H_2) = 0,05 xx 22,4 = 1,12 l`.
Đúng 4
Bình luận (0)
Cho 3,9g K vào nước thu được dung dịch Natrihiđrôxit ( KOH ) và khí hiđrô a)Viết PTHH của phản ứng xảy ra? b)Tính Khối lượng KOH tạo thành c)Tính thể tích H2 thoát ra ở đktc d)Nếu đốt cháy toàn bộ lượng H2 thoát ra ở trên vào trong 6,4g khí Oxi thì thu được bao nhiêu gam nước?
2K+2H2O->2KOH+H2
0,1-----0,1-----0,1---0,05
n K=0,1 mol
=>m KOH=0,1.56=5,6g
=>VH2=0,05.22,4=1,12l
2H2+O2-to>2H2O
0,05--------------0,05
n O2=0,2 mol
=>O2 dư
=>mH2O=0,05.18=0,9g
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 7,7g hỗn hợp gồm hai kim loại Al và Na bằng dung dịch HCl dư thấy thoát ra 7,84 lít khí H2 (ở đktc). Tính thể tích khí H2 thu được khi cho hỗn hợp trên vào lượng nước dư
Hòa tan hoàn toàn 8 gam SO3 vào nước thu được 200 ml dung dịch X.
a) Tính nồng độ mol của dung dịch X.
b) Cho 2,8 gam Fe vào 200 ml dung dịch X, khuấy kĩ để phản ứng xảy ra hoàntoàn. Tính thể tích khí H2 thoát ra ở đktc.
a. \(n_{SO_3}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(C_M=\dfrac{0,1}{200}=0,0005\left(mol\text{/}l\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 16,3g hỗn hợp Na và K vào 1500ml nước, thấy thoát ra 5,6 lít H2(đktc). % khối lượng của K là:
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: 2x x
PTHH: 2K + 2H2O → 2KOH + H2
Mol: 2y y
Ta có: \(\left\{{}\begin{matrix}2x+2y=16,3\\x+y=0,25\end{matrix}\right.\)
⇒ không giải đc (đề sai)
Đúng 0
Bình luận (0)
Câu 3. Hòa tan 5,6g sắt vào dd HCl thu được FeCl2 và H2 a. Tính khối lượng FeCl2 thu được sau phản ứng. b. Tính thể tích khí H2 thoát ra (đktc). c. Tính khối lượng sắt thu được khi dẫn toàn bộ lượng khí thoát ra ở trên đi qua ống đựng 16 gam sắt (III) oxit nung nóng
chỉ cần giải câu c thôi ạ!! giải chi tiết hộ ạ!!
mn giúp mik với ạ mai mik thi rồi!! cảm ơn ạ!!Câu 3:
c, Từ phần trên, có nH2 = nFe = 0,1 (mol)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
Đúng 2
Bình luận (0)
a) \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
0,1-->0,2----->0,1------>0,1
`=> m_{FeCl_2} = 0,1.127 = 12,7 (g)`
b) `V_{H_2} = 0,1.22,4 = 2,24 (l)`
c) `n_{Fe_2O_3} = (16)/(160) = 0,1 (mol)`
PTHH: \(Fe_2O_3+3H_2\xrightarrow[]{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(0,1>\dfrac{0,1}{3}\Rightarrow\) Fe2O3
Theo PT: \(n_{Fe}=\dfrac{2}{3}.n_{H_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
Đúng 1
Bình luận (0)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Theo PTHH: \(n_{Fe}=n_{H_2}=n_{FeCl_2}=0,1\left(mol\right)\)
\(m_{FeCl_2}=n.M=0,1.127=12,7\left(g\right)\)
\(V_{H_2\left(đktc\right)}=n.22,4=0,1.22,4=2,24\left(l\right)\)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{16}{160}=0,1\left(mol\right)\)
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,1}{3}\)
=> sau pư, H2 hết và Fe2O3 dư
=> theo \(n_{H_2}\)
Theo PTHH: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,1=\dfrac{1}{15}\left(mol\right)\)
=> \(m_{Fe}=n.M=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
hòa tan hoàn toàn 46 gam Natri vào 15 gam nước thu được dung dịch A
A ) Tính thể tích khi thoát ra ở đktc
B) Tính nồng % của chất tan trong dung dịch A
\(n_{Na}=\dfrac{46}{23}=2\left(mol\right)\\ n_{H_2O}=\dfrac{15}{18}=\dfrac{5}{6}\left(mol\right)\)
PTHH: 2Na + 2H2O ---> 2NaOH + H2
LTL: \(2>\dfrac{5}{6}\) => Na dư
Theo pthh: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{1}{2}n_{H_2O}=\dfrac{1}{2}.\dfrac{5}{6}=\dfrac{5}{12}\left(mol\right)\\n_{Na\left(pư\right)}=n_{NaOH}=n_{H_2O}=\dfrac{5}{6}\left(mol\right)\end{matrix}\right.\)
=> \(V_{H_2}=\dfrac{5}{12}.22,4=\dfrac{28}{3}\left(l\right)\)
\(m_{dd}=15+23.\dfrac{5}{6}-\dfrac{5}{12}.2=\dfrac{100}{3}\\ m_{NaOH}=\dfrac{5}{6}.40=\dfrac{100}{3}\left(g\right)\\ \rightarrow C\%_{NaOH}=\dfrac{\dfrac{100}{3}}{\dfrac{100}{3}}.100\%=100\%\)
Đúng 6
Bình luận (0)
\(n_{Na}=\dfrac{46}{23}=2\left(mol\right)\\ n_{H_2O}=\dfrac{15}{18}=0,83\left(mol\right)\\ pthh:Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,83 0,83 0,416
\(V_{H_2}=0,416.22,4=9,3l\\
m_{\text{dd}}=46+15-\left(0,416.2\right)=60,17\left(g\right)C\%=\dfrac{0,83.40}{60,17}.100\%=55,176
\%\)
Đúng 1
Bình luận (0)
Bài 5: Hòa tan hoàn toàn 8 gam Ca vào nước.
Viết PTHH?
Tính thể tích H2 thoát ra ở (đktc)
Cho lượng H2 trên đi qua Fe2O3 , to dư. Tính khối lượng Fe tạo thành sau phản ứng?
\(n_{Ca}=\dfrac{8}{40}=0,2\left(mol\right)\)
PTHH: Ca + 2H2O ---> Ca(OH)2 + H2
0,2 0,2
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,2 \(\dfrac{2}{15}\)
\(\rightarrow\left\{{}\begin{matrix}V_{H_2}=0,2.22,4=4,48\left(l\right)\\m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(g\right)\end{matrix}\right.\)
Đúng 4
Bình luận (0)
\(n_{Ca}=8:40=0,2\left(mol\right)\)
pthh : \(Ca+2H_2O->Ca\left(OH\right)_2+H_2\)
0,2 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\)
\(pthh:Fe_2O_3+3H_2-t^o->2Fe+3H_2O\)
0,2 \(\dfrac{2}{15}\)
=> \(m_{Fe}=\dfrac{2}{15}.56=\dfrac{112}{15}\left(G\right)\)
Đúng 1
Bình luận (0)
khi hòa tan H2So4 nhôm vào 200mml dung dịch người ta thấy 2,24 lít khí H2 thoát ra (đktc)
a) tính khối lượng muối thu được sau phản ứng
b) tính nồng độ mol của Axit H2So4 cần dùng
2Al+3H2SO4->Al2(SO4)3+3H2
0,1----------\(\dfrac{1}{30}\)-------0,1 mol
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
=>m Al2(SO4)3=\(\dfrac{1}{30}\).342=11,4g
=>CM H2SO4=\(\dfrac{0,1}{0,2}\)=0,5 M
Đúng 3
Bình luận (2)