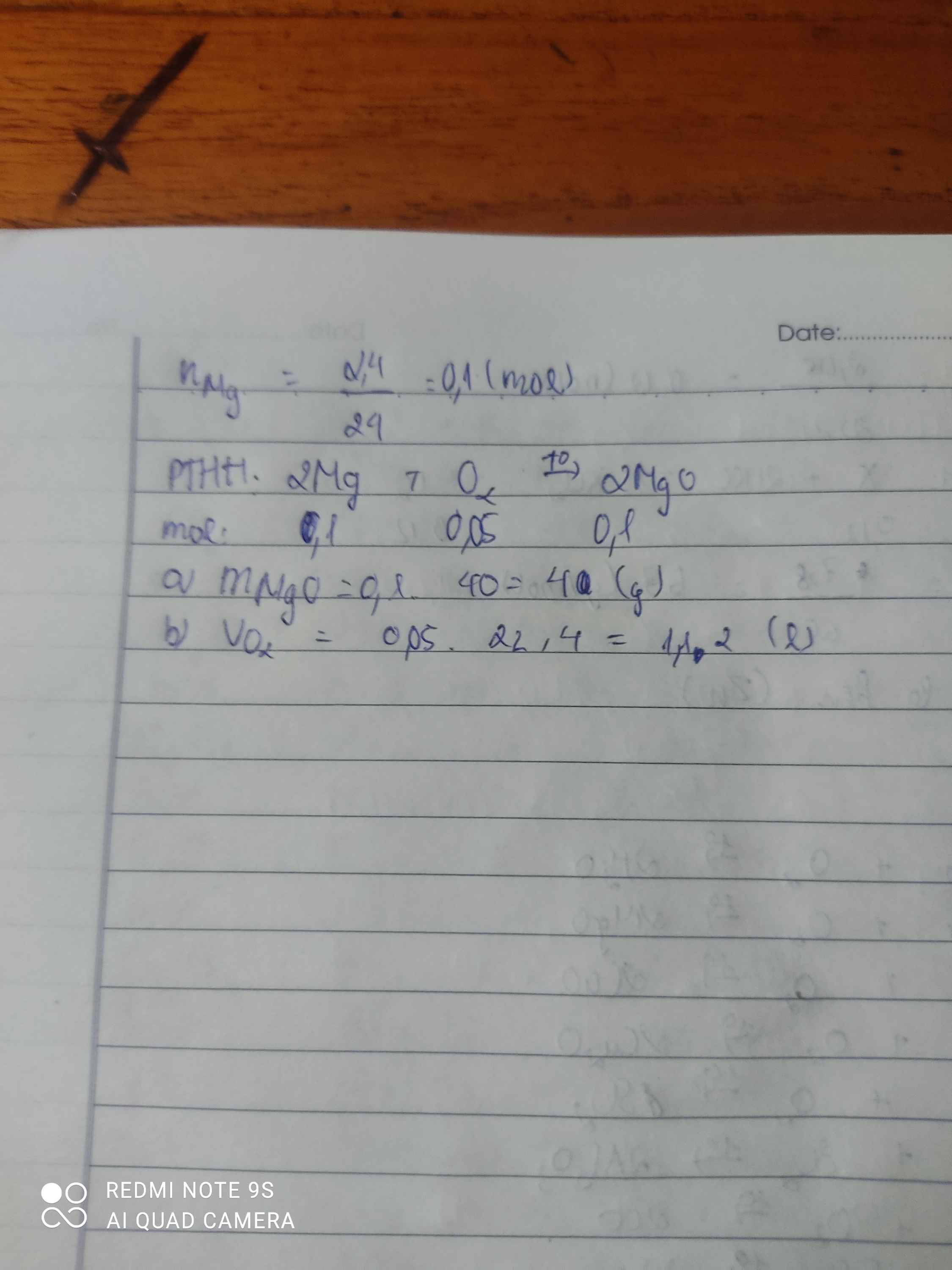đốt cháy 2,6 Mg sắt trong oxi a) cân bằng phương trình b) tính Vo2 c) tính mMgO

Những câu hỏi liên quan
Đốt cháy 11,2 g sắt trong không khí ta thu được 10 oxi sắt (sắt có hóa trị II)
a) viết phương trình hóa học
b) tính khối lượng oxit tạo thành?
c) tính thể tích không khí (biết VO2 chiếm 20% thể tích không khí, các thể tích đó ở điều kiện tiêu chuẩn)
d) dẫn lượng oxit trên qua lượng hidro dư. thể tích hidro (điều kiện tiêu chuẩn) tham gia khử là bao nhiêu?
\(2Fe+O_2\underrightarrow{t^o}2FeO\)
\(nFe=\dfrac{11,2}{56}=0,2\left(mol\right)\)
ũa khoan ??????????????
thu đc 10g oxit sắt r à??????????
Đúng 2
Bình luận (2)
đốt cháy 3.6 gam Magie trong khí oxi dư thu được MgO theo phương trình Mg + O2 -> MgO
a. Cân bằng phương trình phản ứng trên
b. Tính khối lượng MgO tạo thành
Số mol của magie
nMg = \(\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{3,6}{24}=0,15\left(mol\right)\)
a) Pt : 2Mg + O2 → (to) 2MgO\(|\)
2 1 2
0,15 0,15
b) Số mol của magie oxit
nMgO = \(\dfrac{0,15.2}{2}=0,15\left(mol\right)\)
Khối lượng của magie oxit
mMgO = nMgO . MMgO
= 0,15 . 40
= 6 (g)
Chúc bạn học tốt
Đúng 2
Bình luận (2)
HELP mình !!!
cho 2,4g mg đốt cháy hoàn toàn trong O2
a) viết phương trình tính mMgO
b) tính VO2 cần dùng
a: \(2Mg+O_2\rightarrow2MgO\)
\(n_{Mg}=\dfrac{2.4}{24}=0.1\left(mol\right)\)
\(\Leftrightarrow n_{MgO}=0.1\left(mol\right)\)
\(m_{MgO}=0.1\cdot40=4\left(g\right)\)
b: \(n_{O_2}=0.05\left(mol\right)\)
\(V_{O_2}=0.05\cdot22.4=1.12\left(lít\right)\)
Đúng 2
Bình luận (1)
Nếu đốt cháy hết 12 gam kim loại Mg trong không khí thu được 20 gam hợp chất magie oxit (MgO). Biết rằng magie cháy là xảy ra phản ứng với khí oxi trong không khí. a) Viết và cân bằng phương trình hóa học xảy ra. b) Tính thể tích không khí đã tham gia phản ứng (đktc) , biết thể tích O 2 bằng 1/5 thể tích không khí.
\(a,PTHH:2Mg+O_2\xrightarrow{t^o}2MgO\\ b,BTKL:m_{O_2}=m_{MgO}-m_{Mg}=20-12=8(g)\\ \Rightarrow V_{O_2}=\dfrac{8}{32}.22,4=5,6(l)\\ \Rightarrow V_{kk}=\dfrac{5,6}{\dfrac{1}{5}}=28(l)\)
Đúng 0
Bình luận (0)
Đốt cháy 2,4g Mg trong o2 thủ được Mgo tính mo2,co2,mMgO
\(n_{Mg}=\dfrac{2,4}{24}=0,1mol\)
\(2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
0,1 0,05 0,1 ( mol )
\(m_{O_2}=0,05.32=1,6g\)
\(V_{O_2}=0,05.22,4=1,12l\)
\(m_{MgO}=0,1.40=4g\)
Đúng 5
Bình luận (0)
2Mg+O2-to>2MgO
0,1-----0,05-------0,1
n Mg=\(\dfrac{2,4}{24}\)=0,1 mol
=>m O2=0,05.22,4=1,12l
=>m MgO=0,1.40=4g
Đúng 5
Bình luận (0)
Đốt cháy hoàn toàn 16,8 g sắt trong bình khí oxi sao phản ứng thu được sắt từ oxit a. viết phương trình hoá học b. tính thể tích khí oxi ở điều kiện tiêu chuẩn c. tính khối lượng sắt từ oxi giúp em với ạ . em cảm ơnnn
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ a,3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ b,n_{O_2}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ c,n_{Fe_3O_4}=\dfrac{0,3}{3}=0,1\left(mol\right)\\ \Rightarrow m_{Fe_3O_4}=0,1.232=23,2\left(g\right)\)
Đúng 8
Bình luận (0)
Đốt cháy hoàn toàn 46,4 gam sắt trong không khí thì thu được sắt lll oxit là Fe2O3. a/tính khối lượng sắt lll oxit và tính khối lượng oxi cần dùng theo hai cách. b/Tính thể tích không khí cần dùng (ở đktc)? Biết Vo2 = 1/5 Vkk

nFe = 46,4/56 = 29/35 (mol)
PTHH: 4Fe + 3O2 -> (t°) 2Fe2O3
Mol: 29/35 ---> 87/140 ---> 29/70
mFe2O3 = 29/70 . 160 = 464/7 (g)
Vkk = 87/140 . 5 . 22,4 = 69,6 (l)
Đúng 1
Bình luận (0)
Đốt cháy 18.6gram sắt cháy hoàn toàn trong oxi thu được 1 oxi ở nhiệt độ cao
a) Tính số mol và viết phương trình phản ứng
b) tính thể tích oxi cần dùng điều kiện tiêu chuẩn
c)Tính khối lượng oxi thu được
Bài 2 cho 5,4 gram nhôm tác dụng với oxi
a) viết phương trình và tính số mol
b) tính khối lượng sản phẩm tạo thành
c) thể tích oxi cần dùng ở điều kiện tiêu chuẩn
Ai giúp em giải với ạ. Em cảm ơn nhiều
Đọc tiếp
Đốt cháy 18.6gram sắt cháy hoàn toàn trong oxi thu được 1 oxi ở nhiệt độ cao a) Tính số mol và viết phương trình phản ứng b) tính thể tích oxi cần dùng điều kiện tiêu chuẩn c)Tính khối lượng oxi thu được Bài 2 cho 5,4 gram nhôm tác dụng với oxi a) viết phương trình và tính số mol b) tính khối lượng sản phẩm tạo thành c) thể tích oxi cần dùng ở điều kiện tiêu chuẩn Ai giúp em giải với ạ. Em cảm ơn nhiều
Đốt cháy 1,4g sắt trong khí oxi thu được oxit sắt từ Fe3O4.
a/ Viết phương trình hóa học.
b/ Tính thể tích khí oxi đã tham gia phản ứng (ở đktc).
c/ Hãy tính khối lượng oxit sắt từ Fe3O4 thu được theo hai cách
\(a/3Fe+2O_2\xrightarrow[]{t^0}Fe_3O_4\\ b/n_{Fe}=\dfrac{1,4}{56}=0,025mol\\ n_{O_2}=\dfrac{0,025.2}{3}=\dfrac{0,05}{3}mol\\ V_{O_2}=\dfrac{0,05}{3}\cdot22,4\approx0,37l\\ c/C_1\\ n_{Fe_3O_4}=\dfrac{0,025}{3}mol\\ m_{Fe_3O_4}=\dfrac{0,025}{3}\cdot232\approx1,93g\\ C_2\\ m_{O_2}=\dfrac{0,05}{3}\cdot32\approx0,53g\\ BTKL:m_{Fe}+m_{O_2}=m_{Fe_3O_4}\\ \Rightarrow m_{Fe_3O_4}=1,4+0,53=1,93g\)
Đúng 1
Bình luận (0)