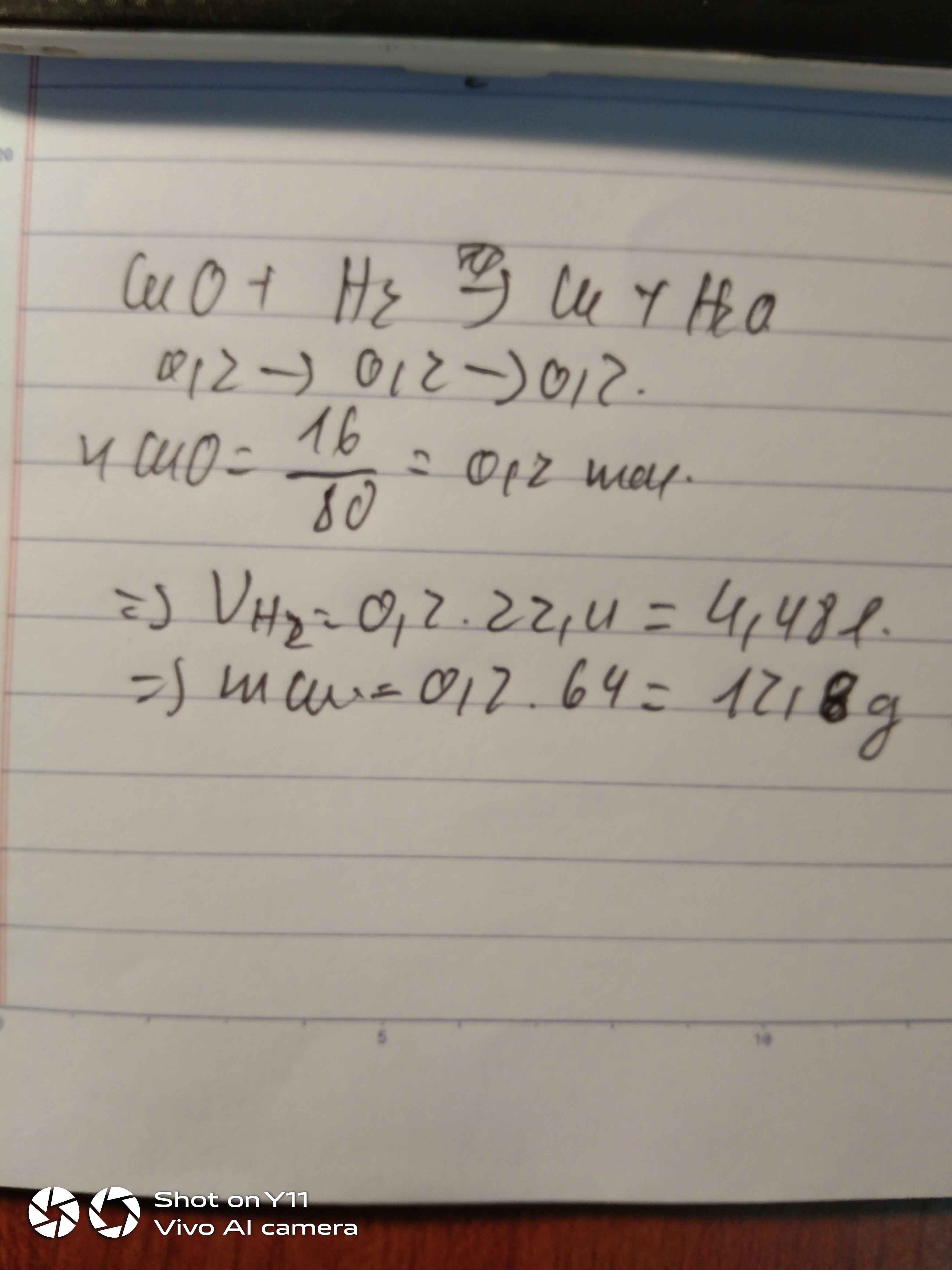Khử 8g Copper (II) oxide bằng khí hidrogen, vt pt và tính khối lượng kim loại thu được

Những câu hỏi liên quan
Khử 8g Copper (II) oxide bằng khí hidrogen, vt pt
Khử 28,8 gam copper (II) oxide bằng khí hydrogen
a) Tính thể tích khí hydrogen cần dùng ở đkc
b) TÍnh khối lượng kim loại đồng tạo thành ( Cu=64, O=16, H=1)
ncu = 28,8/64 = 0,45 mol
CuO + H2 -> Cu + H2O
1 : 1 : 1 : 1
0,45mol
a) nH2 = (0,45.1) : 1 = 0,45 mol
VH2 = 0,45 . 22,4 = 10,08 ( l )
b) mCu = 0,45 . 64 = 28,8 ( g)
CuO+H2-to>Cu+H2O
0,36---0,36----0,36
n CuO=\(\dfrac{28,8}{80}\)=0,36 mol
=>VH2=0,36.22,4=8,064l
=>m Cu=0,36.64=23,04g
Đúng 1
Bình luận (0)
a. \(n_{Cu}=\dfrac{28.8}{64}=0,45\left(mol\right)\)
PTHH : CuO + H2 -> Cu + H2O
0,45 0,45 0,45 0,45
\(V_{H_2}=0,45.22,4=10,08\left(l\right)\)
b. \(m_{Cu}=0,45.64=28,8\left(g\right)\)
Đúng 1
Bình luận (1)
Câu 2: Cho kim loại Zinc pứ vừa đủ với dd chứa 14,6g hydrochloric acid HCl, sau pứ thu được muối zinc chloride ZnCl2 và khí H2
Viết pthh.
Tính thể tích khí H2 ở đktc
Tính khối lượng Zinc?
Dùng toàn bộ khí A khử copper II oxide CuO, tính khối lượng CuO cần dùng?
`@PTHH:`
`Zn + 2HCl -> ZnCl_2 + H_2`
`0,2` `0,4` `0,2` `(mol)`
`n_[HCl]=[14,6]/[36,5]=0,4(mol)`
`@V_[H_2]=0,2.22,4=4,48(l)`
`@m_[Zn]=0,2.65=13(g)`
`@H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,2` `0,2` `(mol)`
`=>m_[CuO]=0,2.80=16(g)`
Đúng 4
Bình luận (0)
Khử 16g Copper(II) oxide (CuO ) bằng khí hydrogen (H2 ) a.Tính thể tích khí hydrogen (H2 ) tham gia phản ứng? b. Tính khối lượng kim loại tạo thành? Fe= 56, O=16, Cu=64, H=1
Câu 4. Khử 8g đồng(II) oxit bằng khí hidro a. Viết PTHH xảy ra. b. Tính khối lượng kim loại thu được c. Tính thể tích khí hiđro (đktc) cần dùng để khử lượng oxit trên.
nCu = 8: 80=0,1(mol)
a) PTHH : CuO + H2 -t--> Cu +H2O
0,1-> 0,1------>0,1(mol)
mCu = 0,1.64=6,4(g)
VH2 = 0,1.22,4=2,24(l)
Đúng 2
Bình luận (0)
Cho 6,5 gam kim loại zinc tác dụng với hydrochloric acid HCl
a/ Nêu hiện tượng xảy ra.
b/ Tính thể tích khí thu được (đktc 25oC, 1 bar)
c/ Dẫn toàn bộ lượng khí sinh ra ở trên đi qua copper (II) oxide nung nóng. Tính khối lượng kim loại tạo thành.
(Zn = 65, O =16, Cu = 64, Cl = 35,5)
Hiện tượng : kẽm bị tan dần , có khí không màu thoát ra .
Zn + 2HCl ---> ZnCl2 + H2
0,1 0,2 0,1 0,1
nZn = 6,5 / 65 = 0,1 ( mol )
V H2 = \(\dfrac{n.R.t}{p}=\dfrac{0,1.0,082.\left(273+25\right)}{1}=2,4436\left(l\right)\)
H2 + CuO ---> Cu + H2O
0,1 0,1
=> mCu = 0,1 . 64 = 6,4 (g)
Đúng 3
Bình luận (0)
: Hòa tan 6 g Magnesium bằng dung dịch hydrochloric acid HCl vừa đủ.
a. Viết PTHH
b. Tính khối lượng muối tạo thành và thể tích khí thoát ra (đkc).
c. Dẫn toàn bộ lượng khí ở trên qua Copper (II) oxide, đun nóng. Tính khối lượng kim loại tạo thành. (Cu=64, Fe=56, Mg=24, O=16, H=1, Zn=65, Cl=35,5)
nMg = 6/24 = 0,25 (mol)
PTHH: Mg + 2HCl -> MgCl2 + H2
nH2 = 0,25 (mol(
VH2 = 0,25 . 24,79 = 6,1975 (l)
CuO + H2 -> (t°) Cu + H2O
nCu = 0,25 (mol)
mCu = 0,25 . 64 = 16 (g)
Đúng 2
Bình luận (0)
Cho luồng khí Hydrogen dư đi qua ống sứ đựng bột Copper (II) Oxide nung nóng, bột Oxide màu đen chuyển thành kim loại đồng màu đỏ và hơi nước ngưng tụa) Viết PTHH của phản ứng xảy ra?b) Cho biết thu được `12,8` g kim loại đồng, hãy tính:`-` Khối lượng Cu (II) Oxide đã tham gia phản ứng.`-` Thể tích khí Hydrogen ở đkc `(25^0 C` và `1` bar`)` đã tham gia phản ứng.`-` Khối lượng hơi nước ngưng tụ tạo thành sau phản ứng._____Yc: Không copy, sao chép câu trả lời từ các nguồn khác. Hoàn toàn là câu tr...
Đọc tiếp
Cho luồng khí Hydrogen dư đi qua ống sứ đựng bột Copper (II) Oxide nung nóng, bột Oxide màu đen chuyển thành kim loại đồng màu đỏ và hơi nước ngưng tụ
a) Viết PTHH của phản ứng xảy ra?
b) Cho biết thu được `12,8` g kim loại đồng, hãy tính:
`-` Khối lượng Cu (II) Oxide đã tham gia phản ứng.
`-` Thể tích khí Hydrogen ở đkc `(25^0 C` và `1` bar`)` đã tham gia phản ứng.
`-` Khối lượng hơi nước ngưng tụ tạo thành sau phản ứng.
_____
Yc: Không copy, sao chép câu trả lời từ các nguồn khác. Hoàn toàn là câu trả lời của mình.
\(H_2+CuO\rightarrow\left(t^o\right)Cu+H_2O\)
0,2 0,2 0,2 0,2
\(b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
\(m_{CuO}=0,2.80=16\left(g\right)\)
\(V_{H_2}=0,2.24,79=4,958\left(l\right)\)
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)
Đúng 3
Bình luận (0)
. Đốt cháy 64g kim loại đồng (copper) thu được 80g đồng (II) oxide (Copper (II) oxide). Biết rằng đồng II oxide (Copper (II) oxide) là hợp chất của Cu(II) và O.
a/ Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử và phân tử của các chất.
b/ Tính khối lượng khí oxygen cần dùng?