Trong một phản ứng có n chất, kể cả chất phản ứng và sản phẩm, nếu biết khối lượng của ……. chất thì tính khối lượng của chất còn lại. Dấu …… là
A. n-1. B. n+1. C. n-2. D. n+2
Trong một phản ứng có n chất, kể cả chất phản ứng và sản phẩm, nếu biết khối lượng của ……. chất thì tính khối lượng của chất còn lại. Dấu …… là
A. n-1. B. n+1. C. n-2. D. n+2
Trong một phản ứng có n chất, kể cả chất phản ứng và sản phẩm, nếu biết khối lượng của ……. chất thì tính khối lượng của chất còn lại. Dấu …… là
A. n-1. B. n+1. C. n-2. D. n+2
Trong mootj phản ứng hóa học có n chất, kể cả chất phản ứng và sản phẩm, nếu biết khối lượng cua (n - 1) chất thì tính được chất còn lại. + n-1 chất là gi vậy
VD p.ứ có 4 chất. (n=4)
Mg+ 2HCl -> MgCl2 + H2
Anh biết khối lượng 3 chất (n-1) là Mg, MgCl2 và H2 lần lượt là 2,4 (g) ; 9,5(g) và 0,2(g) =>Theo ĐLBTKL anh tính được KL của chất còn lại là HCl:
\(m_{Mg}+m_{HCl}=m_{MgCl_2}+m_{H_2}\\ \Leftrightarrow2,4+m_{HCl}=9,5+0,2\\ \Leftrightarrow m_{HCl}=7,3\left(g\right)\)
---
Lấy vd ra cho dễ hiểu. Em hiểu không nè?
1. Trong bình đốt khí người ta dung tia lửa điện để đốt một hỗn hợp gồm60 cm3 gồm khí hiđro và khí oxi.
a) Sau phản ứng còn thừa khí nào không? Thừa bao nhiêu cm3?
b) Tính thể tích và khối lượng hơi nước thu được? (Biết các thể tích khí và hơi đo ở đktc).
2. Để hòa tan hoàn toàn 4 gam hỗn hợp A gồm oxit của Đồng (II) và Sắt (III) cần vừa đủ 25,55 gam dung dịch HCl 20%.
a) Tính khối lượng từng chất trong hỗn hợp A.
b) Nếu đem hỗn hợp A nung nóng trong ống sứ rồi dẫn khí CO đi qua, trong điều kiện thí nghiệm thấy cứ 4 phân tử chất rắn mỗi loại tham gia phản ứng thì có 1 phân tử không tham gia phản ứng. Xác định thành phần và khối lượng chất rắn thu được sau phản ứng trong ống sứ?
Thả 5,6g sắt vào 10,95g axit clohidric
a) Sau phản ứng chất nào còn dư ? Tính khối lượng chất dư
b) Tính khối lượng sản phẩm thu được
c) Nếu dùng toàn bộ lượng khí thu được ở trên để khử (II) oxit thì sau phản ứng thu được bao nhiêu g đồng
a) n Fe = 5,6/56 = 0,1(mol) ; n HCl = 10,95/36,5 = 0,3(mol)
$Fe + 2HCl \to FeCl_2 + H_2$
Ta thấy :
n Fe / 1 = 0,1 < n HCl / 2 = 0,3/2 = 0,15 nên HCl dư
Theo PTHH : n HCl pư = 2n Fe = 0,2(mol)
Suy ra: m HCl dư = 10,95 - 0,2.36,5 = 3,65(gam)
b)
Theo PTHH : n FeCl2 = n H2 = n Fe = 0,1(mol)
m FeCl2 = 0,1.127 = 12,7 (gam)
m H2 = 0,1.2 = 0,2(gam)
c)
$CuO + H_2 \xrightarrow{t^o} Cu + H_2O$
n Cu = n H2 = 0,1(mol)
m Cu = 0,1.64 = 6,4(gam)
1/Nung nóng 1,521g hỗn hợp gồm hai oxit CuO, FeO. Dẫn 0,784 lít khí H2 ở (đktc) đi qua hỗn hợp. Cho biết, kết thúc phản ứng, chất nào tham gia phản ứng hết, chất nào còn dư. Biết hiệu suất phản ứng đạt 100%.
2/ Một loại đá vôi chứa 80% CaCO3 về khối lượng, phần còn lại là chất trơ. Nung 500g đá vôi một thời gian thu được chất rắn có khối lượng bằng 78% khối lượng đá vôi trước khi nung. Tìm hiệu suất của phản ứng .(Biết chất trơ không tham gia phản ứng)
Đề 18:
1) Khi nung đá vôi ta thu được vôi sống và khí cacbonic. Chất rắn thu được so với chất rắn ban đầu có khối lượng tăng hay giảm? Vì sao ?
2) Thể tích của hỗn hợp khí gồm 0,5 mol Co2 và 0,2 mol O2 ở (đktc) là bao nhiêu ?
3) 1 mol S có khối lượng là bao nhiêu ?
4) 0,25 mol phâ tử N2 ( đktc) có thể tích là bao nhiêu ?
5) 1. hãy phát biểu định luật bảo toàn khối lượng ? và giải thích
2. Hãy viết công thức về khối lượng cho phản ứng có 3 chất tham gia và 1 sản phẩm
6) Hãy tính khối lượng của hỗn hợp gồm 0,2 mol NaCl và 8,96 lit Co2 ( đktc) ?
7) Tính thể tích của hỗn hợp gồm 1,25 mol khí Co2 ; 1,7 g H2S và 9.10^23 phân tử CO ở đktc?
9) Hợp chất B có khối lượng mol phân tử là 106g. Thành phần các nguyên tố 43,4 % Na; 11,3 % O. Hãy tìm công thức hóa học của B ?
10) . Phản ứng hóa học là gì ?
Cho 8,1 gam kim loại nhôm tác dụng với 6,72 lít khí Clo ( đktc) thu được sản phẩm là
nhôm clorua.
a) Viết PTHH của phản ứng ? Cho biết phản ứng thuộc loại nào ?
b) Chất nào còn dư sau phản ứng ? Dư bao nhiêu mol ?
c) Tính khối lượng chất còn dư sau phản ứng ?
d) Tính khối lượng sản phẩm thu được ?
\(n_{Al}=\frac{8,1}{27}=0,3\left(mol\right)\)
\(n_{Cl2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(PTHH:2Al+3Cl_2\rightarrow2AlCl_3\)
Ban đầu :___0,3___0,3_____________
\(\frac{0,3}{2}>\frac{0,3}{3}\Rightarrow\) Al dư , Cl hết
Phứng : ___0,2___0,3_________0,2
Dư : ____0,1_____0_______0,2__
\(\Rightarrow m_{Al_{Dư}}=0,1.27=2,7\left(g\right)\)
( Dư 0,1mol)
\(m_{AlCl3}=0,2.133,5=26,7\left(g\right)\)
Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất phản ứng là do trong phản ứng hoá học:
(1) chỉ có liên kết giữa các nguyên tử thay đổi.
(2) số nguyên tử của mỗi nguyên tố giữ nguyên.
(3) khối lượng của các không đổi.
(4) Cả 3 nhận định trên đều đúng.
Giải thích nào đúng:
A. (1).
B. (2) .
C. (3).
D. (4) .
Đun nóng hỗn hợp gồm gồm 6,4g S và 14,3 g Zn trong 1 bình kín, sau phản ứng thu được chất nào? Khối lượng là bao nhiêu? nếu đun hỗn hợp trên ngoài không khí thì sau phản ứng thu được những chất nào ? Tính khối lượng những chất đó ?
V~~, Biếng làm <=> Làm biếng. Tưởng khó lắm ![]()
Bài này là bài toán 2 số liệu thôi! Có gì đâu mà phải hỏi...
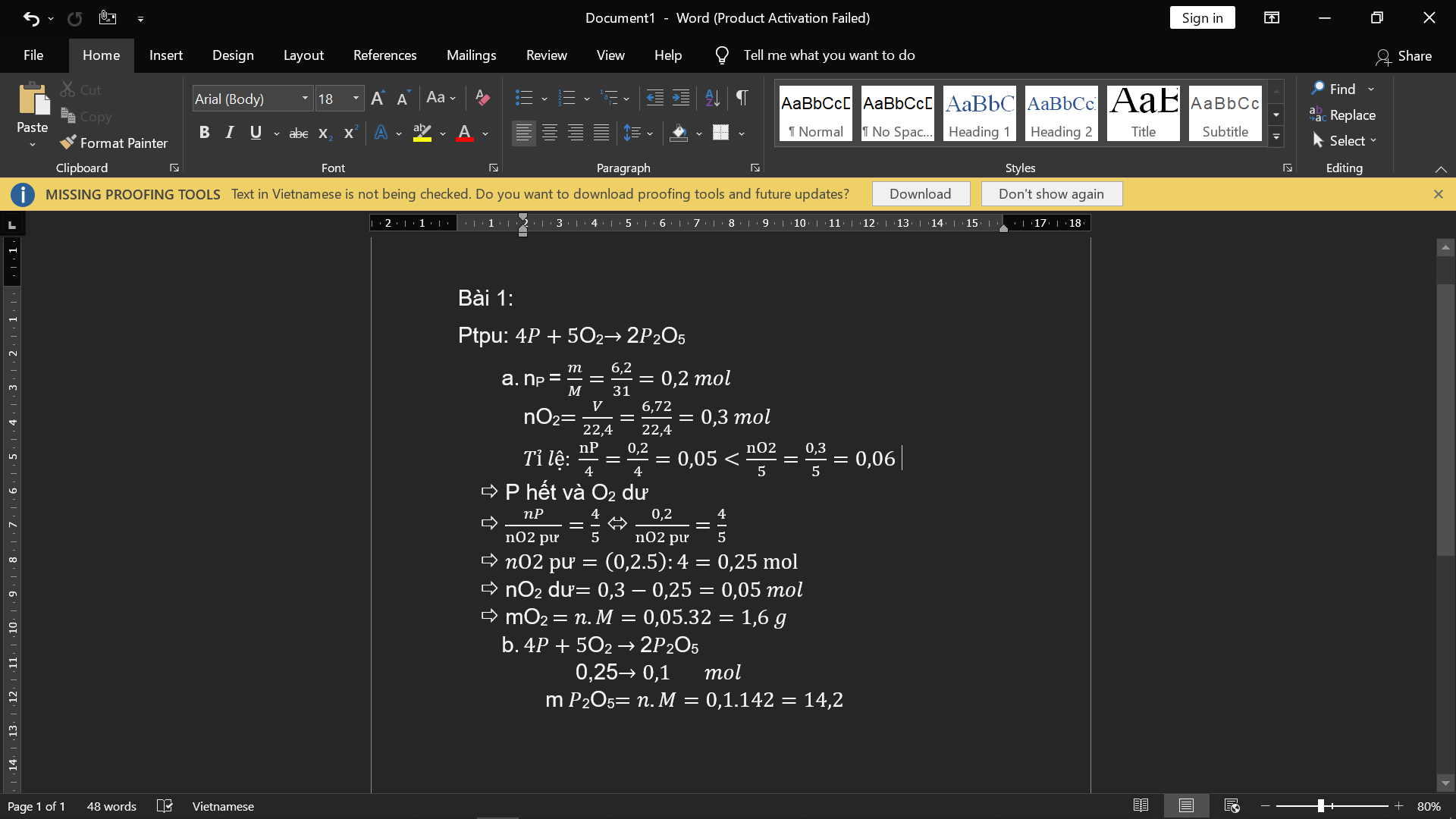
Bài 1: Đốt cháy 6,2(g) P trong bình chứa 6,72(l) khí O2 ở đktc.
a. Sau phản ứng chất nào còn dư và nếu dư thì với khối lượng bao nhiêu? b. Tính khối lượng sản phẩm thu được.
Bài 2: Cho 13g Zn tác dụng với 0,3 mol HCl sau khi kết thúc phản ứng thu được muối kẽm Clorua và khí H2.
a. Viết và cân bằng PTPƯ và cho biết sau khi kết thúc phản ứng thì chất nào còn dư và nếu dư thì dư với khối lượng bao nhiêu?.
b. Tính thể tích của H2 thu được.
Bài 3: Người ta cho 26 g kẽm tác dụng với 49 g H2SO4, sau phản ứng thu được muối ZnSO4, khí hidro và chất còn dư.
a. Viết phương trình phản ứng.
b. Tính thể tích (đktc) khí hidro sinh ra.
c. Tính khối lượng các chất còn lại sau phản ứng.
Bài 4: Nếu cho 4 gam CuO tác dụng với 2,92 g HCl.
a) Cân bằng PTHH.
b) Tính khối lượng các chất còn lại sau phản ứng.
Bài 5: Hòa tan hoàn toàn 15gam CaCO3 vào 200mL dung dịch HCl 2M.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ mol của các chất tan có trong dung dịch thu được.
Bài 6: Hòa tan hết 4,8 gam Magie vào 200 gam dung dịch H2SO4 loãng nồng độ 20%.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ chất tan có trong dung dịch sau phản ứng.
Bài 7: Cho 200 ml dung dịch NaOH nồng độ 2M vào 200 mL dung dịch HCl 4M.
a. Chobiếtchấtnàodưsauphảnứng.
b. Tính nồng độ mol của chất tan trong dung dịch sau phản ứng.
Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)
b ơi đây là bài 1 nka, tí mk làm xog sẽ gửi típ nka ![]()