Cho a gam dung dịch HCl C% tác dụng hết với một lượng hỗn hợp 2 kim loại Na dư và K dư, thấy khối lượng H2 bay ra là 0,05a gam.Tìm C%.

Những câu hỏi liên quan
cho a gam dung dịch HCl C% tác dụng với một lượng hỗn hợp 2 kim loại Na dư và K dư thấy khối lượng H2 bay ra là 0,05 a gam. tìm C phần trăm
Cho a gam dung dịch H2SO4 nồng độ A% tác dụng hết với một lượng hỗn hợp hai kim loại Na và Zn (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05a gam. Tính A
tính bằng cách dùng mol của h2so4 vs h2 nhé
e cảm ơn
\(2Na+H_2SO_4\rightarrow Na_2SO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(nH_2=\dfrac{0,05}{2}=0,025\left(mol\right)\)
=>\(nH_2SO_4=0,025\left(mol\right)\)
=> \(mH_2SO_4=0,025.98=2,45\left(g\right)\)
- muốn tính C% H2SO4 cần thêm dữ kiện .
Đúng 3
Bình luận (0)
Cho a gam dung dịch H2SO4 nồng độ A% tác dụng hết với một lượng hỗn hợp hai kim loại Kali và Magie (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05a gam. Tính A
Đặt a=100 (g)
Theo đề ta có các PTHH:
\(2K+H_2SO_4\xrightarrow[]{}K_2SO_4+H_2\)(1)
\(Mg+H_2SO_4\xrightarrow[]{}MgSO_{4_{ }}+H_2\)(2)
\(2K+2H_2O\xrightarrow[]{}2KOH+H_2\) (3)
(K dùng dư nên cũng tác dụng với H2O)
Theo đề: \(m_{H_2SO_4}=100\times A\%=A\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{A}{98}\left(mol\right)\)
\(n_{H_2}=\dfrac{0,05\times100}{2}=2,5\left(mol\right)\)
\(m_{H_2O}=m_{ddH_2SO_4}-m_{H_2SO_4}=100-A\left(g\right)\)
=>\(n_{H_2O}=\dfrac{100-A}{18}\left(mol\right)\)
Theo PTHH(1),(2),(3) ta có:
\(n_{H_2}=n_{H_2SO_4}+\dfrac{1}{2}\times n_{H_2O}=\dfrac{A}{98}+\dfrac{1}{2}\times\dfrac{100-A}{18}=\dfrac{A}{98}+\dfrac{100-A}{36}=2,5\left(mol\right)\)
=> A=15,8
Vậy nồng độ dung dịch H2SO4 là 15,8%
Đúng 0
Bình luận (0)
\(PTHH:\)
\(H_2SO_4+2K--->K_2SO_4+H_2\) \((1)\)
\(H_2SO_4+Mg--->MgSO_4+H_2\) \((2)\)
\(mH_2SO_4=\)\(\dfrac{C\%H_2SO_4.mddH_2SO_4}{100}\)\(=\)\(\dfrac{Aa}{100} (g)\)
\(=> nH_2SO_4=\dfrac{Aa}{100}.98=0,98Aa (mol)\)
\(nH_2=\dfrac{0,05a}{2} = 0,025a (mol)\)
Theo PTHH (1) và (2) \(nH_2SO_4=nH_2\)
\(<=> 0,98Aa=0,025a\)
\(<=> 0,98A=0,025\)
\(<=> A=39,2 \)
Vậy nồng độ phần trăm của dung dich \(H_2SO_4\) cần tìm là \(39,2\%\)
Đúng 0
Bình luận (3)
Cho m gam dung dịch H2SO4 nồng độ C% tác dụng hết với một lượng hỗn hợp hai kim loại kali và magie (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05m gam. Giá trị của C là: A. 19,73% B. 15,80% C.17,93% D. 18,25%
Đọc tiếp
Cho m gam dung dịch H2SO4 nồng độ C% tác dụng hết với một lượng hỗn hợp hai kim loại kali và magie (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05m gam. Giá trị của C là:
A. 19,73%
B. 15,80%
C.17,93%
D. 18,25%
Cho m gam dung dịch H2SO4 nồng độ C% tác dụng hết với một lượng hỗn hợp hai kim loại kali và magie (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05m gam. Giá trị của C là: A. 19,73% B. 15,80% C.17,93% D. 18,25%
Đọc tiếp
Cho m gam dung dịch H2SO4 nồng độ C% tác dụng hết với một lượng hỗn hợp hai kim loại kali và magie (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05m gam. Giá trị của C là:
A. 19,73%
B. 15,80%
C.17,93%
D. 18,25%
Đáp án B
Chọn m = 100 (gam). Vì kim loại dùng dư nên sau khi axit hết, K tác dụng với nước cũng sinh H2.
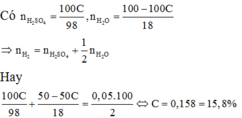
Đúng 0
Bình luận (0)
Câu 3 : Cho 11,9 gam hỗn hợp gồm 2 kim loại Zn và Al tác dụng với dd HCl dư thấy thoát ra 9,916 lít khí H2 (đkc). a) Tính khối lượng mỗi kim loại trong hỗn hợp ban đầu. b) Tính khối lượng muối tạo thành. c) Tính khối lượng dung dịch HCl 10% cần dùng
a, Ta có: 65nZn + 27nAl = 11,9 (1)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=n_{Zn}+\dfrac{3}{2}n_{Al}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Al}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ mZn = 0,1.65 = 6,5 (g)
mAl = 0,2.27 = 5,4 (g)
b, Theo PT: nZnCl2 = nZn = 0,1 (mol)
nAlCl3 = nAl = 0,2 (mol)
⇒ m muối = 0,1.136 + 0,2.133,5 = 40,3 (g)
c, Theo PT: nHCl = 2nH2 = 0,8 (mol)
\(\Rightarrow m_{ddHCl}=\dfrac{0,8.36,5}{10\%}=292\left(g\right)\)
Đúng 2
Bình luận (0)
Cho hỗn hợp Al và Mg tác dụng hết với dung dịch HCl dư, thấy bay ra 2,24 lít H2 (đktc). Cũng cho lượng hỗn hợp trên tác dụng với dung dịch NaOh dư thu được 1,2g chất rắn không tan. Tính thành phần phần trăm các kim loại trong hỗn hợp.
\(m_{Mg}=1,2\left(g\right)\)
=> \(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
____0,05--------------------->0,05
2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{30}\)<--------------------0,05
=> \(m_{Al}=\dfrac{1}{30}.27=0,9\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,9}{0,9+1,2}.100\%=42,857\%\\\%Mg=\dfrac{1,2}{0,9+1,2}.100\%=57,143\%\end{matrix}\right.\)
Đúng 0
Bình luận (0)
Cho a gam dd H2SO4 loãng nồng độ C% tác dụng với một lượng hh hai kim loại Na và Mg ( dùng dư ) thì khối lượng H2 tạo thành là 0,05a gam. Tính C
$m_{H_2SO_4} = a.C\%(gam) \Rightarrow n_{H_2SO_4} = \dfrac{a.C\%}{98}$
$m_{H_2O\ trong\ dd\ axit} = a - a.C\% \Rightarrow n_{H_2O} = \dfrac{a - a.C\%}{18}$
$2Na + H_2SO_4 \to Na_2SO_4 + H_2$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Na + 2H_2O \to 2NaOH + H_2$
Theo PTHH :
$n_{H_2} = n_{H_2SO_4} + \dfrac{1}{2}n_{H_2O}$
$\Rightarrow \dfrac{0,05a}{2} = \dfrac{a.C\%}{98} + \dfrac{1}{2}.\dfrac{a - a.C\%}{18}$
$\Rightarrow C\% = 0,158 = 15,8\%$
Đúng 2
Bình luận (0)
: Cho 2,06 gam hỗn hợp 2 kim loại Na và Ba tác dụng với một lượng nước dư, thấy thoát ra 0,56 lít khí H2 (đktc).
a) Tính tổng khối lượng bazơ sinh ra.
b) Tính khối lượng từng kim loại trong hỗn hợp.
2Na+2H2O->2NaOH+H2
x-------------------x----------0,5x mol
Ba+2H2O->Ba(OH)2+H2
y---------------------y----------y mol
aTa có :)\(\left\{{}\begin{matrix}23x+137y=2,06\\0,5x+y=0,025\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,03\\y=0,01\end{matrix}\right.\)
=>mbazo=0,03.40+0,01.171=2,91g
=>m Na=0,03.23=0,69g
=>m Ba=0,01.137=1,27g
Đúng 2
Bình luận (1)






















