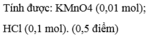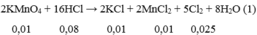Cho 10,8g Al vào 300g dd HCl 3,65%. Khi phản ứng xảy ra hoàn toàn thu đc dd X và V l khí H2(đktc). Tính V và nồng độ phần trăm của X

Những câu hỏi liên quan
Cho 6,9 g Natri vào 200 g dd HCl 3,65% sau phản ứng hoàn toàn chỉ thu được dd A và có V lít khí H2 thoát ra
a,Viết PTHH và tính V
b,Tính nồng độ phần trăm các chất tan có trong A
\(n_{Na}=\dfrac{6,9}{23}=0,3\left(mol\right)\\ m_{HCl}=200.3,65\%=7,3\left(g\right)\\ n_{HCl}=\dfrac{7,3}{36,5}=0,2\left(mol\right)\)
\(PTHH:2Na+2HCl\rightarrow2NaCl+H_2\uparrow\\ LTL:0,3>0,2\Rightarrow Na.dư\)
Theo pt: nH2 = 2nHCl = 2.0,2 = 0,4 (mol)
VH2 = 0,4.22,4 = 8,96 (l)
Theo pt: nNaCl = nNa (phản ứng) = nHCl = 0,2 (mol)
=> \(\left\{{}\begin{matrix}m_{NaCl}=0,2.58,5=11,7\left(g\right)\\m_{Na\left(dư\right)}=\left(0,3-0,2\right).23=2,3\left(g\right)\\m_{H_2}=0,4.2=0,8\left(g\right)\end{matrix}\right.\)
=> \(m_{dd}=200+6,9-2,3-0,8=203,8\left(g\right)\)
=> C%NaCl = \(\dfrac{11,7}{203,8}=5,74\%\)
Đúng 3
Bình luận (0)
hòa tan hoàn toàn 13,9g hh gồm al và fe trong đd axit hcl 14,6% vừa đủ sau phản ứng thoát ra 7,84 l khí h2 ở đktc , thu đc dd X
a) vieeta pthh
b)tính khối lượng mỗi kim loại trong hh ban đầu
c) tính nồng độ phần trăm mỗi muối trong dd X
\(\text{Đặt }n_{Al}=x(mol);n_{Fe}=y(mol)\\ \Rightarrow 27x+56y=13,9(1)\\ n_{H_2}=\dfrac{7,84}{22,4}=0,35(mol)\\ a,PTHH:2Al+6HCl\to 2AlCl_3+3H_2(1)\\ Fe+2HCl\to FeCl_2+H_2(2)\\ b,\text{Từ 2 PT: }1,5x+y=0,35(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,2(mol)\\ \Rightarrow m_{Al}=0,1.27=2,7(g)\\ m_{Fe}=0,2.56=11,2(g)\)
\(c,n_{HCl(1)}=3n_{Al}=0,3(mol);n_{AlCl_3}=0,1(mol);n_{H_2(1)}=0,15(mol)\\ \Rightarrow m_{dd_{HCl(1)}}=\dfrac{0,3.36,5}{14,6\%}=75(g)\\ \Rightarrow C\%_{AlCl_3}=\dfrac{0,1.133,5}{2,7+75-0,15.2}.100\%=17,25\%\)
\(n_{HCl(2)}=2n_{Fe}=0,4(mol);n_{FeCl_2}=n_{H_2(2)}=n_{Fe}=0,2(mol)\\ \Rightarrow m{dd_{HCl(2)}}=\dfrac{0,4.36,5}{14,6\%}=100(g)\\ \Rightarrow C\%_{FeCl_2}=\dfrac{0,2.127}{11,2+100-0,2.2}.100\%=22,92\%\)
Đúng 1
Bình luận (0)
a) 2Al + 6HCl --> 2AlCl3 + 3H2
Fe + 2HCl --> FeCl2 + H2
b) Gọi số mol Al, Fe lần lượt là a,b
=> 27a + 56b = 13,9
\(n_{H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
2Al + 6HCl --> 2AlCl3 + 3H2
a----->3a--------->a------->1,5a______(mol)
Fe + 2HCl --> FeCl2 + H2
b------>2b-------->b----->b__________(mol)
=> 1,5a + b = 0,35
=> \(\left\{{}\begin{matrix}a=0,1=>m_{Al}=0,1.27=2,7\left(g\right)\\b=0,2=>m_{Fe}=0,2.56=11,2\left(g\right)\end{matrix}\right.\)
c) nHCl = 3a + 2b = 0,7 (mol)
=> mHCl = 0,7.36,5 = 25,55(g)
=> \(m_{ddHCl}=\dfrac{25,55.100}{14,6}=175\left(g\right)\)
\(m_{dd\left(saupu\right)}=13,9+175-2.0,35=188,2\left(g\right)\)
\(\left\{{}\begin{matrix}m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\\m_{FeCl_2}=0,2.127=25,4\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C\%\left(AlCl_3\right)=\dfrac{13,35}{188,2}.100\%=7,1\%\\C\%\left(FeCl_2\right)=\dfrac{25,4}{188,2}.100\%=13,5\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 7.2g mg vào 200ml dd hcl 1.5m sau khi phản ứng xảy ra hoàn toàn thu đc dd x và v lít khí ở đktc tính khối lượng muối tạo thành và giá trị của v?
Xem chi tiết
\(n_{Mg}=0,3\left(mol\right)\)
\(n_{HCl}=0,3\left(mol\right)\)
\(PTHH:Mg+2HCl\rightarrow MgCl_2+H_2\)
...............0,15......0,3..........0,15.....0,15......
- Thấy sau phản ứng HCl phản ứng hết, Mg còn dư ( dư 0,15 mol )
\(\Rightarrow\left\{{}\begin{matrix}m_M=m_{MgCl_2}=14,25\left(g\right)\\V=V_{H_2}=3,36\left(l\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
\(n_{HCl}=0,2.1,5=0,3\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,3}{2}\), ta được Mg dư.
Theo PT: \(n_{MgCl_2}=n_{H_2}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{MgCl_2}=0,15.95=14,25\left(g\right)\\V_{H_2}=0,15.22,4=3,36\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Cho 44.8 lít khí Hcl ở đktc hòa tan toàn vào 2gam nước thì thu được dd A
a/ Tính nồng độ phần trăm của dd A
b/ cho 50gam CaCO3 vào 250gam vào dd A đem đun nhẹ đến phản ứng xảy ra hoàn toàn thì thu đc dd B .Tính nồng độ phần trăm của các chất trong dd B
Cho 1,58 gam K M n O 4 vào 100 ml dd HCl 1M. Sau phản ứng hoàn toàn, thu được V lít khí C l 2 (đktc) và dd X. Viết phương trình phản ứng xảy ra và tính V?
Cho 13g Zn t/d với 300g dd HCl 7,3% thu đc dd X và khí V(l) khí H2 (đktc)
a. Tính VH2 thu đc (đktc)
b. Tính nồng độ phần trăm của dd A
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2___ 0,4_____0,2_____0,2
\(n_{Zn}=\frac{13}{65}=0,2\left(mol\right)\)
\(n_{HCl}=\frac{300.7,3}{10.36,5}=0,6\left(mol\right)\)
Lập tỉ lệ hết với dư:
\(\frac{0,2}{1}< \frac{0,6}{2}\)
Vậy Zn hết, HCl dư
\(a,V_{H2}=0,2.22,4=4,48\left(l\right)\)
b, Dd A: ZnCl2
\(m_{Dd}=300-\left(0,2.2\right)=299,6\left(g\right)\)
\(m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(\rightarrow C\%_{ZnCl2}=\frac{27,2}{299,6}=9,08\%\)
cho 2,7g Al tác dụng với 600g dd HCl 3,65% phản ứng hoàn toàn, thu được, và giải phóng V lít H2(đktc) V=?
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(n_{Al}=\dfrac{2.7}{27}=0.1\left(mol\right)\)
\(\Leftrightarrow n_{AlCl_3}=0.1\left(mol\right)\)
\(\Leftrightarrow n_{HCl}=0.3\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=0.6\left(mol\right)\)
\(V=0.6\cdot22.4=13.84\left(lít\right)\)
Đúng 1
Bình luận (2)
Ta có: \(n_{HCl}=\dfrac{\dfrac{3,65\%.600}{100\%}}{36,5}=0,6\left(mol\right)\)
\(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(PTHH:2Al+6HCl--->2AlCl_3+3H_2\uparrow\)
Ta thấy: \(\dfrac{0,1}{2}< \dfrac{0,6}{6}\)
Vậy HCl dư, Al hết
Theo PT: \(n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,1=0,15\left(mol\right)\)
\(\Rightarrow V=V_{H_2}=0,15.22,4=3,36\left(lít\right)\)
Đúng 3
Bình luận (1)
Bn tính số mol á, bạn lấy tỉ lệ số mol với tỉ lệ PT, số mol cao hơn thì chất đó dư, ta tính theo chất còn lại
Đúng 1
Bình luận (1)
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
A. 48,6%.
B. 49,6%.
C. 27,0%.
D. 54,0%.
Chọn đáp án B
Vì glyxin có 1 nhóm –COOH ⇒ nGlyxin = nNaOH = 0,1 mol.
⇒ VNaOH = 0,1 ÷ 1 = 0,1 lít = 100 ml ⇒ Chọn B
Đúng 0
Bình luận (0)
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
A. 48,6%.
B. 49,6%.
C. 27,0%.
D. 54,0%.
Chọn đáp án D
Nhận thấy chỉ có Al tác dụng được với HCl.
+ Bảo toàn e ⇒ nAl = 2 × nH2 ÷ 3 = 0,1 mol ⇒ mAl = 2,7 gam
⇒ %mAl/hỗn hợp = 2 , 7 5 × 100 = 54% ⇒ Chọn D
Đúng 0
Bình luận (0)