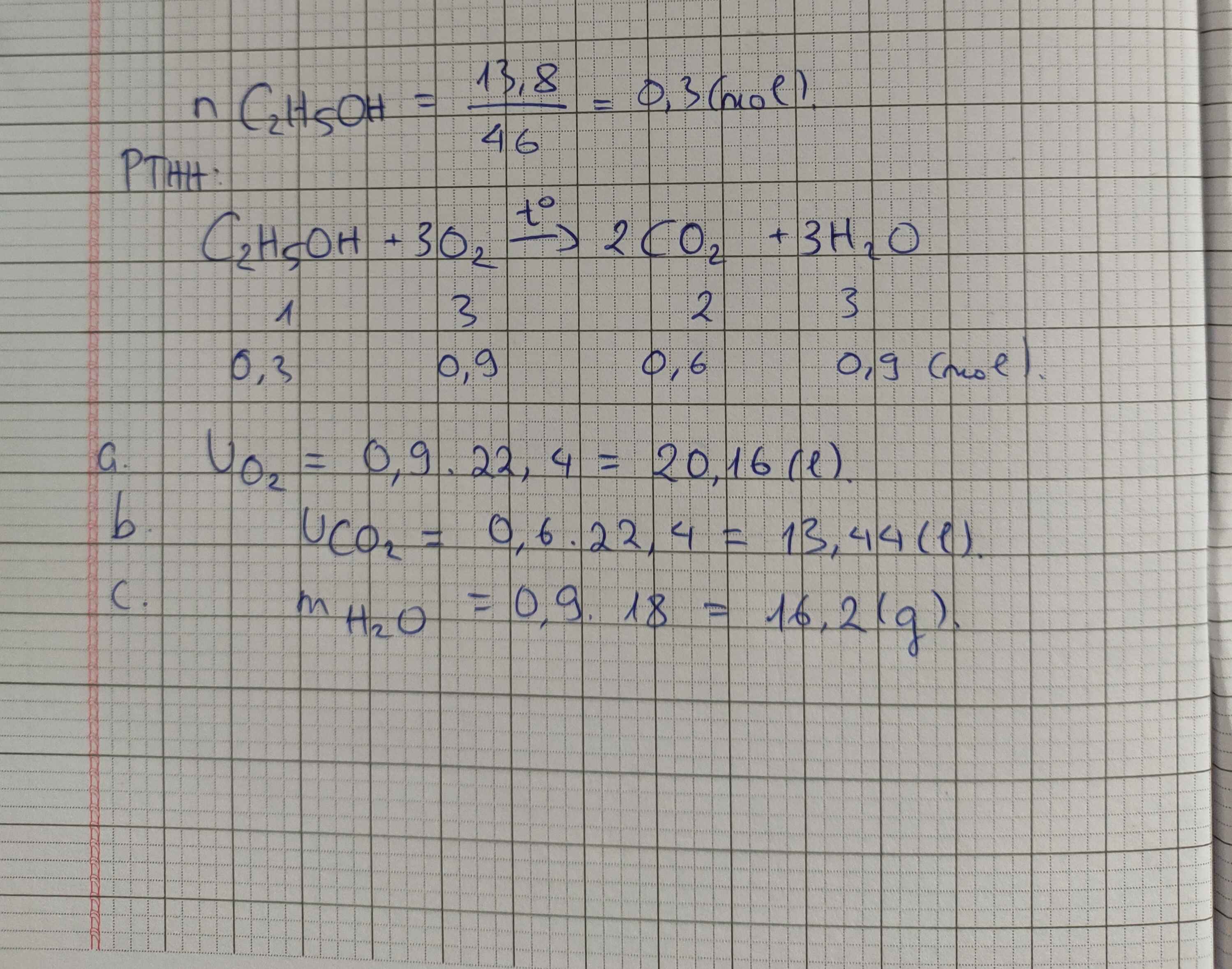đốt cháy hoàn toàn mg và cu sau phản ứng thu được 12 g tính thể tích oxi cần dùng (giúp với )

Những câu hỏi liên quan
ghi lại đề đốt cháy hoàn toàn Mg và Cu sau phản ứng kết thúc thu được 12 gam.Hỗn hợp hai oxit (gồm CuOMgO).tính thể tích cần dùng ở đktc
Thấy đánh lại đề mà vẫn thấy nó lằng nhằng+khó hiểu+thiếu:vv
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 26,4 g hỗn hợp Mg cu Zn trong oxi dư kết thúc phản ứng thu được 36 g hỗn hợp oxit Viết phương trình và tính thể tích khí oxi đã phản ứng ở điều kiện tiêu chuẩn
Xem chi tiết
\(2Mg+O_2\rightarrow2MgO\)
\(2Cu+O_2\rightarrow2CuO\)
\(2Zn+O_2\rightarrow2ZnO\)
- Áp dụng định luật bảo toàn khối lượng :
\(m_{KL}+m_{O_2}=m_{oxit}\)
\(\Rightarrow m_{O_2}=36-26,4=9,6\left(g\right)\)
\(\Rightarrow n_{O_2}=\dfrac{m}{M}=0,3\left(mol\right)\)
\(\Rightarrow V_{o_2}=n.22,4=6,72\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn một lượng bột nhôm trong không khí sau phản ứng thu được 20,4 g một oxit
a Tính khối lượng nhôm đã tham gia phản ứng
b tính thể tích khí oxi và thể tích không khí cần dùng biết khí oxi chiếm 20% thể tích không khí
giải nhanh giúp mik vs ạ
4Al+3O2-to>2Al2O3
0,4----0,3---------0,2 mol
n Al2O3=\(\dfrac{20,4}{102}\)=0,2 mol
=>m Al=0,4.27=10,8g
=>VO2=0,3.22,4=6,72l
=>Vkk=6,72.5=33,6l
Đúng 3
Bình luận (0)
4Al + 3O2 ---> 2Al2O3
0,4 0,3 0,2
nAl2O3 = 20,4 / 102 = 0,2 ( mol )
=> mAl = 0,4 . 27 = 10,8 (g)
V O2 = 0,3.22,4 = 6,72(l)
Vkk = 6,72 . 5 = 33,6(l)
Đúng 2
Bình luận (0)
nAl2O3 = 20,4/102 = 0,2 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,1 <--- 0,3 <--- 0,2
mAl = 0,1.27 = 2,7 (g)
Vkk = 0,3.22,4.5 = 33,6 (l)
VO2 = 0,3 . 22,4 = 6,72 (l)
Đúng 1
Bình luận (1)
Đốt cháy hoàn toàn bột nhôm trong khí õi. Sau phản ứng xảy ra hoàn toàn thu được 2.04g nhôm oxit. Tính thể tích oxi cần dùng cho phản ứng ở đktc Giúp mk vs
Ta có: \(n_{Al_2O_3}=\dfrac{2,04}{102}=0,02\left(mol\right)\)
PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
_________0,03____0,02 (mol)
⇒ VO2 = 0,03.22,4 = 0,672 (l)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Số mol của nhôm oxit
nAl2O3 = \(\dfrac{m_{Al2O3}}{M_{Al2O3}}=\dfrac{2,04}{102}=0,02\left(mol\right)\)
Pt : 4Al + 3O2 → 2Al2O3\(|\)
4 3 2
0,03 0,02
số mol của khí oxi
nO2= \(\dfrac{0,02.3}{2}=0,03\left(mol\right)\)
Thể tích của khí oxi ở dktc
VO2 = nO2 . 22,4
= 0,03 . 22,4
=0,672 (l)
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn một lượng bột nhôm trong không khí sau phản ứng thu được 20,4 g một oxit
a Tính khối lượng nhôm đã tham gia phản ứng
b tính thể tích khí oxi và thể tích không khí cần dùng biết oxi chiếm 20% thể tích không khí
lm nhanh giúp mik vs ạ
\(n_{Al_2O_3}=\dfrac{m_{Al_2O_3}}{M_{Al_2O_3}}=\dfrac{20,4}{102}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,4 0,3 0,2 ( mol )
\(m_{Al}=n_{Al}.M_{Al}=0,4.27=10,8g\)
\(V_{kk}=V_{O_2}.5=\left(0,3.22,4\right).5=6,72.5=33,6l\)
Đúng 2
Bình luận (1)
mol Al2O3=mA PTHH:Al l2O3/MAl2O3 =20.4÷(27×2+16×3)=0.2(mol)
PTHH:4Al+3O2--t°-->2Al2O3
mol--0.4----0.3-----------0.2
-->m Al phản ứng=nAl×MAl=0.2×27=5.4(g)
b, Vo2=no2×22.4=0.3×22.4=6.72(l)
--->Vkk cần dùng=6.72×100%÷20%=33.6(l)
Vậy.....
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn một lượng bột nhôm trong bình đựng khí oxi. Sau phản ứng thu được 20,4 g nhôm oxit(Al2O3).
a. Viết phương trình hóa học của phản ứng.
b. Tính thể tích khí oxi cần dùng ở đktc.
c. Tính thể tích không khí cần dùng ở đktc Nếu đốt lượng bộ nhôm ở trên trong không khí.( biết khí oxi chiếm khoảng 20% thể tích không khí)
( biết: Al 27; O 16).
Mn giải giúp mk bài này với ạ.
Cảm ơn mn🥰🥰🥰.
Đọc tiếp
Đốt cháy hoàn toàn một lượng bột nhôm trong bình đựng khí oxi. Sau phản ứng thu được 20,4 g nhôm oxit(Al2O3). a. Viết phương trình hóa học của phản ứng. b. Tính thể tích khí oxi cần dùng ở đktc. c. Tính thể tích không khí cần dùng ở đktc Nếu đốt lượng bộ nhôm ở trên trong không khí.( biết khí oxi chiếm khoảng 20% thể tích không khí) ( biết: Al = 27; O = 16). Mn giải giúp mk bài này với ạ. Cảm ơn mn🥰🥰🥰.
a, \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
b, \(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{2}n_{Al_2O_3}=0,3\left(mol\right)\Rightarrow V_{O_2}=0,3.22,4=6,72\left(l\right)\)
c, \(V_{kk}=\dfrac{V_{O_2}}{20\%}=33,6\left(l\right)\)
Đúng 2
Bình luận (0)
a, Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
b, Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là
a, Theo giả thiết ta có: \(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(4P+5O_2--t^o->2P_2O_5\)
Ta có: \(n_{O_2}=\dfrac{5}{4}.n_P=0,125\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=0,125.22,4=2,8\left(l\right)\)
b, Theo giả thiết ta có: \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(CH_4+2O_2--t^o->CO_2+2H_2O\)
Ta có: \(n_{O_2}=2.n_{CH_4}=0,1\left(mol\right)\Rightarrow V_{O_2\left(đktc\right)}=2,24\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 15,6gam hỗn hợp 2 kim loại Mg và Al trong bình đựng khí oxi, sau phản ứng xảy ra hoàn toàn thu được 28,4gam hỗn hợp 2 oxit. Thể tích khí oxi(ở đktc) đã dùng để đốt cháy lượng kim loại trên
Theo ĐLBT KL, có: mKL + mO2 = m oxit
⇒ mO2 = 28,4 - 15,6 = 12,8 (g)
\(\Rightarrow n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\Rightarrow V_{O_2}=0,4.22,4=8,96\left(l\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 13,8 gam rượu etylic cần dùng V lít oxi (ở đktc), sau phản ứng thu được khí cacbonic và nước.
a/ Tính thể tích oxi phản ứng.
b/ Tính thể tích khí cacbonic tạo thành.
c/ Tính khối lượng nước tạo thành.