Cho biết: Na: 23; O: 16; S: 32; Fe: 56; Al: 27 . Phân tử khối của Na₂O, Al₂(SO₄)₃ , Fe₂O₃. Lần lượt là :
A) 62 đvC, 342 đvC, 160g
B) 62 g, 342 đvC, 160 đvC
C) 62 đvC, 342g, 160 đvC
D) 62 đvC, 342 đvC, 160 đvC
Cho biết khối lượng của 1 nguyên tử C = 1,9926 .10-23 g. Biết Na = 23, C = 12. Hãy tính xem khối lượng tính bằng gam của nguyên tử Na bằng bao nhiêu ?
Ta có: nC= \(\dfrac{1,9926.10^{-23}}{12}\) = 1,6605.10-24
=> mNa = ( 1,6605. 10-24) .23= 3,81915.10-23
Lập công thức hóa học của các hợp chất sau : a) Na(l) và O(ll) b) Mg(ll) và (SO4) (ll)
( cho biết Na=23;O=16;C=12;H=1)
Cho biết số đơn vị điện tích hạt nhân, số proton, số electron và số notron của 23/11 Na , 19/9 F
\(^{23}_{11}Na\\ \Rightarrow\left\{{}\begin{matrix}P=E=Z=11\\N=A-Z=23-11=12\end{matrix}\right.\\ ^{19}_9F\\ \Rightarrow\left\{{}\begin{matrix}P=E=Z=9\\N=A-Z=19-9=10\end{matrix}\right.\)
Hợp chất của Na (I) và OH (I), có PTK là: (đơn vị đvC) (Biết: Na: 23, O: 16, H: 1)
4,3g hỗn hợp Na + Ca trong Không khí.Sau phản ứng thu được 5,9 g chất rắn
a.Viết PT
b.Khối lượng của mỗi Kim loại trong hỗn hợp
Cho biết Na=23 Ca=40
Đề bài là đốt hỗn hợp Na + Ca trong không khí bạn nhỉ?
a, PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
\(2Ca+O_2\underrightarrow{t^o}2CaO\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Na}=x\left(mol\right)\\n_{Ca}=y\left(mol\right)\end{matrix}\right.\)
⇒ 23x + 40y = 4,3 (1)
Theo PT: \(\left\{{}\begin{matrix}n_{Na_2O}=\frac{1}{2}n_{Na}=\frac{1}{2}x\left(mol\right)\\n_{CaO}=n_{Ca}=y\left(mol\right)\end{matrix}\right.\)
⇒ 62.1/2x + 56y = 5,9
⇒ 31x + 56y = 5,9 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,1.23=2,3\left(g\right)\\m_{Ca}=0,05.40=2\left(g\right)\end{matrix}\right.\)
Bạn tham khảo nhé!
Tính toán các yêu câu sau
Hợp chất B cấu tạo từ Na và S. Tìm B biết rằng % Na trong hợp chất B là 58,97% và MB=78g/mol
Biết Na=23, S=32
\(CT:Na_xS_y\)
\(\%Na=\dfrac{23x}{78}\cdot100\%=58.97\%\)
\(\Rightarrow x=2\)
\(M=23\cdot2+32y=78\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow y=1\)
\(CT:Na_2S\)
Hh X gồm Na và A1. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dd NaOH (dư) thì được 1 ,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X 1à (biết các thể tích khí đo trong cùng điều kiện, cho Na: 23, A1: 27)
A. 39, 87%
B. 73,1%
C. 49, 87%
D. 29,87%
Đáp án D
Do các khí đo ở cùng điều kiện nên ta “có thể” coi V như số mol để tính cho đơn giản.
TH1:
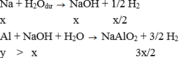
TH2:
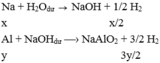
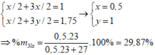
Cho biết mp= 1,007276u,mn=1,008665u,m( 1123 Na)=22,9897u; m(1122 Na)=21,9944u :1u=931MeV/c2 .năng lượng cần để bứt một notron ra khỏi hạt nhân của đồng vị 1123 Na bằng
A:12,42MeV
B:12,42KeV
C:124,2MeV
D:12,42eV
Ta có: \(^{23}_{11}Na \rightarrow ^{22}_{11}Na+^1_0n\)
Năng lượng cần để bứt một nơ trôn ra khỏi hạt nhân của \(^{23}_{11}Na\) bằng năng lượng thu vào của phản ứng trên,
Tính bằng: \((21,9944+1,008665-22,9897).931=12,42MeV\)
Chọn A.
Chúc bạn học tốt ![]() và nhớ tích đúng cho mình nhé
và nhớ tích đúng cho mình nhé ![]()
Cho các chất sau: Cl ₂ , CuSO ₄ , HCI, NaOH. Phân tử khối của các chất lần lượt là: (Biết H=1,O = 16, Na = 23, Cl = 35.5 , Cu = 64
PTK:
Cl2: 35,5 . 2 = 71 đvC
CuSO4: 64.1 + 32.1 + 16.4 = 160 đvC
HCl: 1.1 + 35,5.1 = 36,5 đvC
NaOH: 23.1 + 16.1 + 1.1 = 40 đvC
Bài 1: Cho hợp chất Y tạo bởi NA,S,O có tỉ lệ khối lượng mNa : mS:mO = 23:16:24. Xác định CTPT của hợp chất Y biết 1 phân tử Y chứa 2 nguyên tử Na
giúp mình vs ạ
gọi công thức tổng quát của Y là NaxSyOz
ta có : mNa:mS:mO=23:16:24
=>23x:32y:16z=23:16:24
=>x:y:z=23/23:16/32:24/16
=>x:y:z=1:0,5:1,5(chia cho 0,5)
=>x=2,y=1,z=3
=>CTPT là: Na2SO3