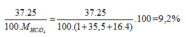Trong tự nhiên, Clo có 2 đồng vị C 35 l và C 37 l , trong đó đồng vị chiếm C 35 l 75% về số đồng vị. Nguyên tử khối trung bình của Cl là
A. 35,54.
B. 35,50.
C. 36,5.
D. 35,6.
Câu 8: Trong tự nhiên, nguyên tố clo có 2 đồng vị \(^{35}_{17}Cl;^{37}_{17}Cl\) có % số nguyên tử tương ứng là 75% và 25%. Nguyên tố đồng có 2 đồng vị, trong đó \(^{63}_{29}Cu\) chiếm 73% số nguyên tử. Đồng và clo tạo được hợp chất CuCl2 trong đó % khối lượng Cu chiếm 47,228%. Tìm số khối của đồng vị còn lại của đồng.
+) Ta có:A¯Cl=35,75+37,25\100=35,5
+) Gọi a là số khối trung bình của Cu
=>%mCu=a\a+35,5.2.100%=47,228%=>a=63,54%
+) Đồng vị 63Cu chiếm 73% => đồng vị còn lại có số khối là x chiếm 27%
=>(63.73+x.27)\100=63,54=>x=65
Vậy đồng vị còn lại là 65Cu
Câu 8:Trong tự nhiên, nguyên tố clo có 2 đồng vị \(^{35}_{17}Cl,^{37}_{17}Cl\) có % số nguyên tử tương ứng là 75% và 25%. Nguyên tố đồng có 2 đồng vị, trong đó \(^{63}_{29}Cu\)Cuchiếm 73% số nguyên tử. Đồng và clo tạo được hợp chất CuCl2 trong đó % khối lượng Cu chiếm 47,228%. Tìm số khối của đồng vị còn lại của đồng.
30. Nguyên tố Clo trong tự nhiên gồm 2 đồng vị bền là 1735Cl và 3717Cl, biết rằng 7,108 gam khí Clo chiếm thể tích 2,24 lít (đktc). Xác định thành phần % về số mol của các đồng vị 1735Cl và 1737Cl lần lượt là?
Trong tự nhiên Clo có 2 đồng vị là 35Cl và 37Cl có NTK TB là 35.5 Tính số nguyên tử đồng vị Cl trong 3.65g HCl
Nguyên tố Clo trong tự nhiên gồm 2 đồng vị bền 1735Cl và 1737Cl, biết rằng 7,108 gam khí Clo chiếm thể tích 2,24 lít(đktc). Xác địng thành phần phần trăm về số mol của các đồng vị 1735Cl và 1737Cl lần lượt là?
Trong tự nhiên đồng vị 1737Cl chiếm 24,23% số nguyên tử clo, còn lại là 1735Cl. Tính thành phần % về khối lượng 1737Cl có trong HClO4(H đồng vị 1, O đồng vị 16. Nguyên tử khối trung bình của Cl là 35,5
Đặt số mol HClO4 là 1 mol ⇒ có 0,2423 mol 37Cl ( Vì đồng vị 37Cl chiếm 24,23% số nguyên tử clo mà số nguyên tử\(=n.N_A\)
\(\%m^{37}Cl=\dfrac{0,2423.37}{1+35,5+16.4}.100\%\approx8,92\%\)
Khối lượng nguyên tử trung bình của Clo là 35,5. Clo trong tự nhiên có 2 đồng vị là 35 và 37. Hỏi \(\frac{37}{17}\)Cl chiếm bao nhiêu % về khối lượng trong phân tử axit pecloric HClO4
Gọi: x là % nguyên tử \(\frac{35}{17}Cl\) và (100-x ) là % nguyên tử \(\frac{37}{17}Cl\)
Ta có : x + y = 100 (1)
Mặt khác :
\(\overline{M}=\frac{35x+37y}{100}=35.5\)
<=> 35x + 37y = 3550 (2)
Giải (1) và (2) :
x = 75
y = 25
Vậy: \(\frac{37}{17}Cl\) chiếm 25% khối lượng trong phân tử HClO4
Coi %Cl(37) =x thì %Cl(35)=1-x
Theo bài ra : 37x+35(1-x)=35,5
Suy ra x= 0,25
Vậy %Cl(37) = 37.0,25.100%/1+35,5+16.4 = 9,2%
Câu 1: trong tự nhiên, đồng có 2 đồng vị 63/29 Cu và 65/29 Cu trong đó đồng vị 65/29 Cu chiế 27,0% về số nguyên tử. phần trăm khối lượng của 63/29 Cu trong CuCl2 là giá trị bao nhiêu?
Câu 2: trong tự nhiên Clo có 2 đồng vị bền 37/17 Cl chiếm 24,23% tổng số nguyên tử còn lại là 37/17 Cl. Thành phần phần trăm theo khối lượng của 37/17 Cl trong HClO4 là bao nhiêu?
Câu 20. Trong tự nhiên nguyên tố clo có 2 đồng vị \(\frac{35}{ }Cl\) và \(\frac{37}{ }Cl\) có % số lượng nguyên tử tương ứng là 75% và 25%. Nguyên tố Cu có 2 đồng vị trong đó \(\frac{63}{ }Cu\) chiếm 73% số lượng nguyên tử. Biết Cu và Clo tạo được hợp chất CuCl2 trong đó Cu chiếm 47,228% khối lượng.Xác định đồng vị thứ 2 của Cu
Tham khảo:
Số khối trung bình của Cl = ( 35.75 +37.25) :100 = 35,5
Gọi a là số khối trung bình của Cu
=> %Cu = a : ( a + 35,5 . 2 ) = 47,228%
=> a = 63,54
Đồng vị 63 Cu chiếm 73 % --> Đồng vị còn lại có số khối x chiếm 27%
--> ( 63.73 + x.27 ) : 100 = 63,54
--> x = 65
Vậy đồng vị còn lại là 65 Cu
+) Tính \(\overline{A_{Cl}}=\frac{35,75+37,25}{100}\)
+) Tính \(\%M_{Cu}=\frac{a}{a+35,5.2}.100\)
+) Đồng vị 63Cu chiếm 73%
=> đồng vị còn lại có số khối là x chiếm 27%
Nguyên tử khối trung bình của Clo là 35,5. Clo trong tự nhiên có hai đồng vị là 35 Cl và 37 Cl. Tính phần trăm về khối lượng của 37 Cl chứa trong HClO4 (với Hidro đồng vị là 1 H, oxi đồng vị là 16 O)
\(\%^{35}Cl=x\%\Rightarrow\%^{37}Cl=\left(100-x\right)\%\)
\(\overline{M}=\dfrac{35x+37\cdot\left(100\%-x\right)}{100\%}=35.5\left(g\text{/}mol\right)\)
\(\Rightarrow x=75\%\)
\(\%^{37}Cl_{\left(HClO_4\right)}=\dfrac{25\%\cdot37}{1+35.5+16\cdot4}\cdot100\%=9.2\%\)
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4=