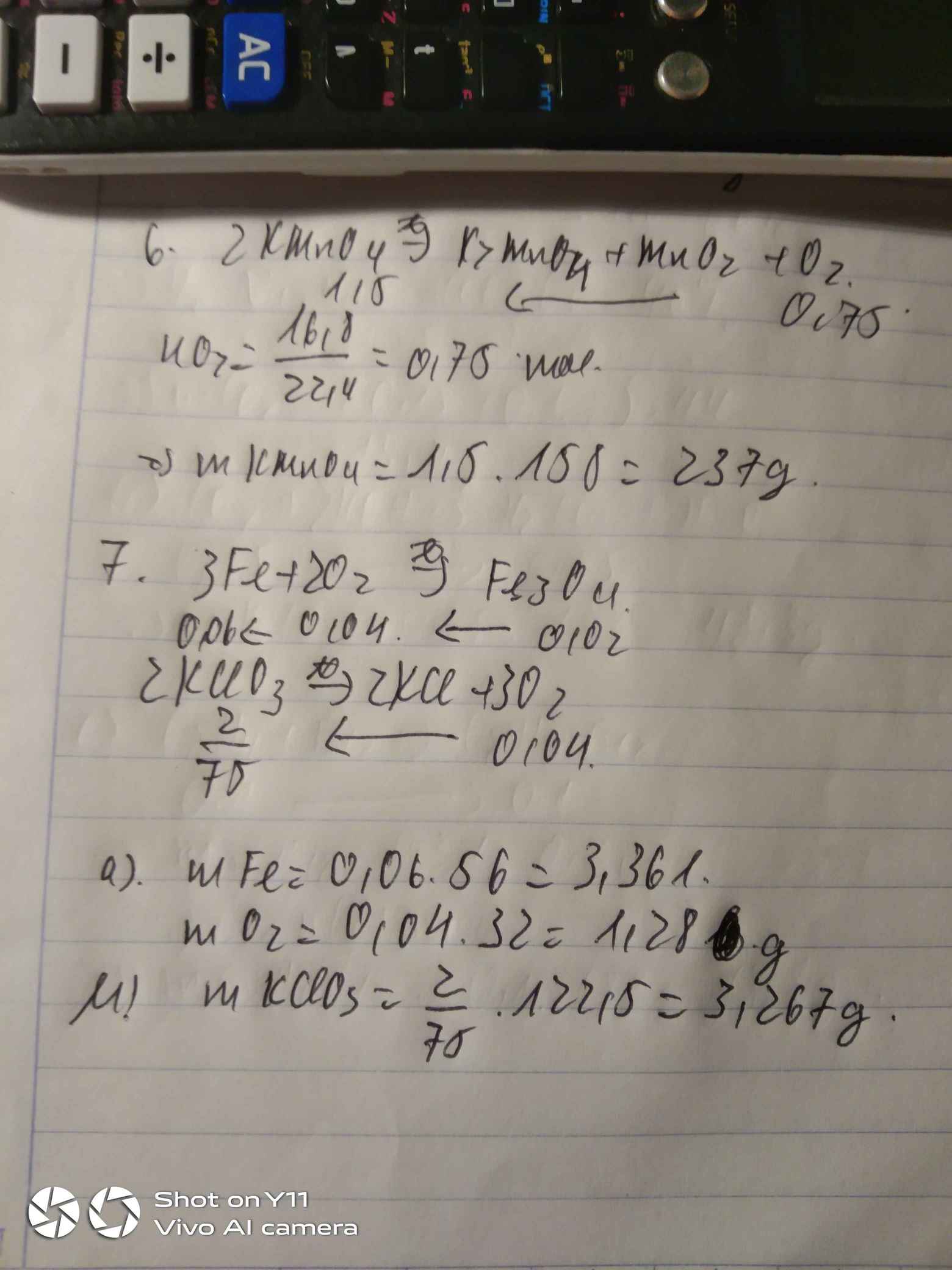Nung nóng hoàn toàn 9,8 g kali clorat có xúc tác MnO2 để điều chế khí oxi. a) Viết PTHH b) Tính thể tích khí oxi thu được (đktc). c) Dùng lượng khí oxi trên để đốt cháy một mẩu photpho. Tính khối lượng photpho có thể bị đốt cháy hết

Những câu hỏi liên quan
Nung nóng kali clorat có xúc tác là MnO2 thu được kali clorua và khí oxi. a. Nung nóng 12,25 gam kali clorat thu được 6,8 gam kali clorua. Tính hiệu suất của phản ứng này. b. Tính khối lượng kali clorat cần dùng để điều chế được 6,72 lít khí oxi (đktc). Biết hiệu suất phản ứng là 85%.c. Tính khối lượng oxi điều chế được khi phân hủy 24,5 g kali clorat. Biết hiệu suất phản ứng là 80%.
Đọc tiếp
Nung nóng kali clorat có xúc tác là MnO2 thu được kali clorua và khí oxi.
a. Nung nóng 12,25 gam kali clorat thu được 6,8 gam kali clorua. Tính hiệu suất của phản ứng này.
b. Tính khối lượng kali clorat cần dùng để điều chế được 6,72 lít khí oxi (đktc). Biết hiệu suất phản ứng là 85%.
c. Tính khối lượng oxi điều chế được khi phân hủy 24,5 g kali clorat. Biết hiệu suất phản ứng là 80%.
2KClO3-to\xt->2KCl+3O2
0,1------------------0,1
n KClO3=\(\dfrac{12,25}{122,5}\)=0,1 mol
=>m KCl=0,1.74,5=7,45g
H=\(\dfrac{6,8}{7,45}.100\)=91,275%
b)
2KClO3-to\xt->2KCl+3O2
0,2-------------------------0,3 mol
n O2=\(\dfrac{6,72}{22,4}\)=0,3 mol
H=85%
=>m KClO3=0,2.122,5.\(\dfrac{100}{85}\)=28,82g
c)
2KClO3-to\xt->2KCl+3O2
0,2------------------------0,3
n KClO3=\(\dfrac{24,5}{122,5}\)=0,2 mol
H=80%
=>m O2=0,3.32.\(\dfrac{80}{100}\)=10,4g
Đúng 3
Bình luận (0)
đốt cháy hoàn toàn 3,6g magie trong khí oxi
a)tính thể tích khí oxi cần dùng
b)nếu dùng kali clorat (có xúc tác Mno2)để điều chế được khí oxi trên thì khối lượng kali clorat cần dùng là bao nhiêu
Theo gt ta có: $n_{Mg}=0,15(mol)$
a, $2Mg+O_2\rightarrow 2MgO$
Ta có: $n_{O_2}=0,5.n_{Mg}=0,075(mol)\Rightarrow V_{O_2}=1,68(l)$
b, $2KClO_3\rightarrow 2KCl+3O_2$ (đk: nhiệt độ, MnO2)
Ta có: $n_{KClO_3}=\frac{2}{3}.n_{O_2}=0,05(mol)\Rightarrow m_{KClO_3}=6,125(g)$
Đúng 0
Bình luận (0)
\(n_{Mg}=\dfrac{3.6}{24}=0.15\left(mol\right)\)
\(2Mg+O_2\underrightarrow{t^0}2MgO\)
\(0.15......0.075......0.15\)
\(V_{O_2}=0.075\cdot22.4=1.68\left(l\right)\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(0.05.......................0.075\)
\(m_{KClO_3}=0.05\cdot122.5=6.125\left(g\right)\)
Đúng 0
Bình luận (0)
Theo gt ta có: nMg=0,15(mol)nMg=0,15(mol)
a, 2Mg+O2→2MgO2Mg+O2→2MgO
Ta có: nO2=0,5.nMg=0,075(mol)⇒VO2=1,68(l)nO2=0,5.nMg=0,075(mol)⇒VO2=1,68(l)
b, 2KClO3→2KCl+3O22KClO3→2KCl+3O2 (đk: nhiệt độ, MnO2)
Ta có: nKClO3=2/3.nO2=0,05(mol)⇒mKClO3=6,125(g)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Nung hoàn toàn 49kg Kali clorat để điều chế khí oxi a) Viết PTHH b) Tính thể tích khí oxi thu được (đktc)
nKClO3= 49/122,5=0,4(mol)
a) PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
b) nO2=3/2 . nKClO3= 3/2 . 0,4= 0,6(mol)
=> V(O2,dktc)=0,6 x 22,4= 13,44 (l)
Đúng 3
Bình luận (1)
nKClO3= 49/122,5=0,4(mol)
a) PTHH: 2 KClO3 -to-> 2 KCl + 3 O2
b) nO2=3/2 . nKClO3= 3/2 . 0,4= 0,6(mol)
=> V(O2,dktc)=0,6 x 22,4= 13,44 (l)
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 3,6 gam magie trong khí oxi trên thì khối lượng kali clorat cần dùng.
A. Tính thể tích khí oxi (đktc) cần dùng?
B. Nếu dùng dịch KCLO3(có xúc tác MnO2) để điều chế lượng khí oxi trên thì khối lượng kali clorat cần dùng là bao nhiêu?
(O=16,CL=35,5,K=39,Mn=55)
2Mg+O2-to>2MgO
0,15---0,075 mol
2KClO3-to->2KCl+3O2
0,05-----------------------0,075
n Mg=\(\dfrac{3,6}{24}\)=0,15 mol
=>VO2=0,075.22,4=1,68l
=>m KClO3=0,05.122,5=6,125g
Đúng 3
Bình luận (0)
a. \(n_{Mg}=\dfrac{3.6}{24}=0,15\left(mol\right)\)
PTHH : 2Mg + O2 ----to----> 2MgO
0,15 0,075
\(V_{O_2}=0,075.22,4=1,68\left(l\right)\)
b. PTHH : 2KClO3 \(\xrightarrow[MnO_2]{t^o}\) 2KCl + 3O2
0,05 0,075
\(m_{KClO_3}=0,05.122,5=6,125\left(g\right)\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 3,6 g mg trong khí oxi.
a/ Tính thể tích khí oxi ở đktc .
b/ Nếu dùng kali clorat ( chất xúc tác MnO2 ) để điều chế lượng khí oxi thì lượng kali clorat cần dùng là bao nhiêu ?
a)
\(n_{Mg} = \dfrac{3,6}{24} = 0,15(mol)\\ 2Mg + O_2 \xrightarrow{t^o} 2MgO\\ n_{O_2} = \dfrac{1}{2}n_{Mg} = 0,075(mol)\\ \Rightarrow V_{O_2} = 0,075.22,4 = 1,68(lít)\)
b)
\(2KClO_3 \xrightarrow{t^o,MnO_2} 2KCl + 3O_2\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = \dfrac{2}{3}.0,075 = 0,05(mol)\\ \Rightarrow m_{KClO_3} = 0,05.122,5 = 6,125(gam)\)
Đúng 2
Bình luận (0)
kali clorat được sử dụng để làm thuốc pháo, ngòi nổ, thuốc đầu diêm và là thuốc giúp nhãn ra hoa... cũng như thuốc tím, ở nhiệt độ cao (có mặt MnO2 làm xúc tác) kali clorat bị phân hủy giải phóng khí oxia, hãy viết pthh điều chế oxi từ thuốc tím và từ kali cloratb, nếu muốn thu được cùng một lượng khí oxi thì dùng hóa chất nào sẽ tiết kiệm được hóa chất hơn? giải thích?
Đọc tiếp
kali clorat được sử dụng để làm thuốc pháo, ngòi nổ, thuốc đầu diêm và là thuốc giúp nhãn ra hoa... cũng như thuốc tím, ở nhiệt độ cao (có mặt MnO2 làm xúc tác) kali clorat bị phân hủy giải phóng khí oxi
a, hãy viết pthh điều chế oxi từ thuốc tím và từ kali clorat
b, nếu muốn thu được cùng một lượng khí oxi thì dùng hóa chất nào sẽ tiết kiệm được hóa chất hơn? giải thích?
a)
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$
$2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2$
b)
Coi n O2 = 1(mol)
Theo PTHH :
n KMnO4 = 2n O2 = 2(mol)
n KClO3 = 3/2 n O2 = 1,5(mol)
Ta thấy :
m KMnO4 = 2.158 =316 > m KClO3 = 122,5.1,5 = 183,75
Nên dùng KClO3 tiết kiệm được hóa chất hơn
Đúng 2
Bình luận (0)
a)
2KMnO4->K2MnO4+MnO2+O2
2KClO3->2KCl+3O2
b)
gọi a là số mol O2
=>nKMnO4=2a mol
nKClO3=2a/3 mol
mKMnO4=158x2a=316a g
mKClO3=122,5x2a/3=81,67a g
=> KClO3 tiết kiệm hơn
Đúng 0
Bình luận (1)
Để điều chế khí oxi trong phòng thí nghiệm, người ta nung nóng 55,125 gam kali clorat KClO3 ở nhiệt độ cao với chất
xúc tác MnO2. Tính thể tích khí oxi thu được ở đktc, biết hiệu suất của phản ứng đạt 85%.
\(n_{KClO_3\left(bd\right)}=\dfrac{55,125}{122,5}=0,45\left(mol\right)\)
=> \(n_{KClO_3\left(pư\right)}=\dfrac{0,45.85}{100}=0,3825\left(mol\right)\)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
0,3825------------------->0,57375
=> \(V_{O_2}=0,57375.22,4=12,852\left(l\right)\)
Đúng 4
Bình luận (0)
2KClO3-to>2KCl+3O2
0,45---------------------0,675 mol
n KClO3=\(\dfrac{55,125}{122,5}\)=0,45 mol
=>H=85%
=>VO2=0,675.22,4.\(\dfrac{85}{100}\)=12,852l
Đúng 3
Bình luận (1)
Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Đọc tiếp
Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).
Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Câu 6.
\(n_{O_2}=\dfrac{16,8}{22,4}=0,75mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1,5 0,75
\(m_{KMnO_4}=1,5\cdot158=237g\)
Câu 7.
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,04 0,02
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{75}\) 0,04
\(m_{KClO_3}=\dfrac{2}{75}\cdot122,5=\dfrac{49}{15}\approx3,27g\)
Đúng 3
Bình luận (1)
Bài 6 :
\(n_{O_2}=\dfrac{16.8}{22,4}=0,75\left(mol\right)\)
PTHH : 2KMnO4 ----t0-----> K2MnO4 + MnO2 + O2
1,5 0,75
\(m_{KMnO_4}=1,5.158=237\left(g\right)\)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Nung hoàn toàn 12,15 g kali clorat KClO3 ở nhiệt độ cao thấy thoát ra V lít khí oxi thoát ra (đktc). a) Viết PTHH của phản ứng đã xảy ra b) Tính thể tích khí oxi thu được c) Tính khối lượng kẽm cần dùng khi phản ứng với lượng khí oxi được điều chế ở phản ứng trên
a)PTHH:2KClO\(_3\)➞\(^{t^o}\)2KCl+3O\(_2\)
b) n\(_{KClO_3}\)=\(\dfrac{m_{KClO_3}}{M_{KClO_3}}\)=\(\dfrac{12,15}{122,5}\)\(\approx\)0,1(m)
PTHH : 2KClO\(_3\) ➞\(^{t^o}\) 2KCl + 3O\(_2\)
tỉ lệ : 2 2 3
số mol : 0,1 0,1 0,15
V\(_{O_2}\)=n\(_{O_2}\).22,4=0,15.22,4=3,36(l)
c)PTHH : 2Zn + O\(_2\) -> 2ZnO
tỉ lệ : 2 1 2
số mol :0,3 0,15 0,3
m\(_{Zn}\)=n\(_{Zn}\).M\(_{Zn}\)=0,3.65=19,5(g)
Đúng 1
Bình luận (0)
1) Dùng 4,48 lít khí H2(đktc) khử hoàn toàn đồng (II) oxit ở nhiệt độ cao. Tính khối lượng đồng sinh ra trong phản ứng trên?
2) Trong phòng thí nghiệm người ta điều chế O2 bằng cách nung nóng kali clorat xúc tác manga dioxit
a) Tính thể tích oxi (đktc) thu được khi có 36,75g kali clorat bị phân hủy
b) Lượng oxi thu được đốt cháy được bao nhiêu gam sắt?
1)
H2+CuO->Cu+H2O
0,2-----------0,2 mol
nH2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m Cu=0,2.64=12,8g
2)
2KClO3-to>2KCl+3O2
0,3----------------------0,45 mol
n KClO3=\(\dfrac{36,75}{122,5}\)=0,3 mol
=>VO2=0,45.22,4=10,08l
3Fe+2O2-to>Fe3O4
0,675--0,45 mol
=>m Fe=0,675.56=37,8g
Đúng 3
Bình luận (2)