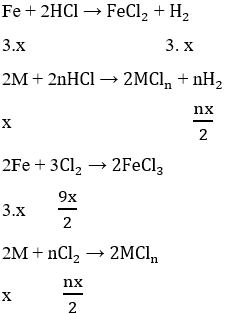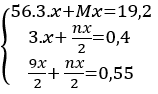Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, th...
Đọc tiếp
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
Cho 7,5 gam hỗn hợp X gồm kim loại M (hóa trị không đổi) và Mg (tỉ lệ mol tương ứng 2 : 3) tác dụng với 3,36 lít Cl2, thu được hỗn hợp rắn Y. Hòa tan hết toàn bộ Y trong lượng dư dung dịch HCl, thu được 1,12 lít H2. Biết các phản ứng đều xảy ra hoàn toàn, các thể tích khí đều đo ở đktc. Kim loại M là
A. Al.
B. Na
C. Ca.
D. K.









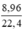 = 0,4 (mol)
= 0,4 (mol)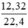 = 0,55 (mol)
= 0,55 (mol)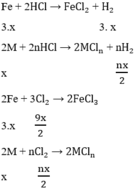
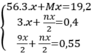
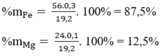





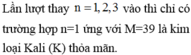






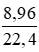 = 0,4 (mol)
= 0,4 (mol)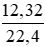 = 0,55 (mol)
= 0,55 (mol)