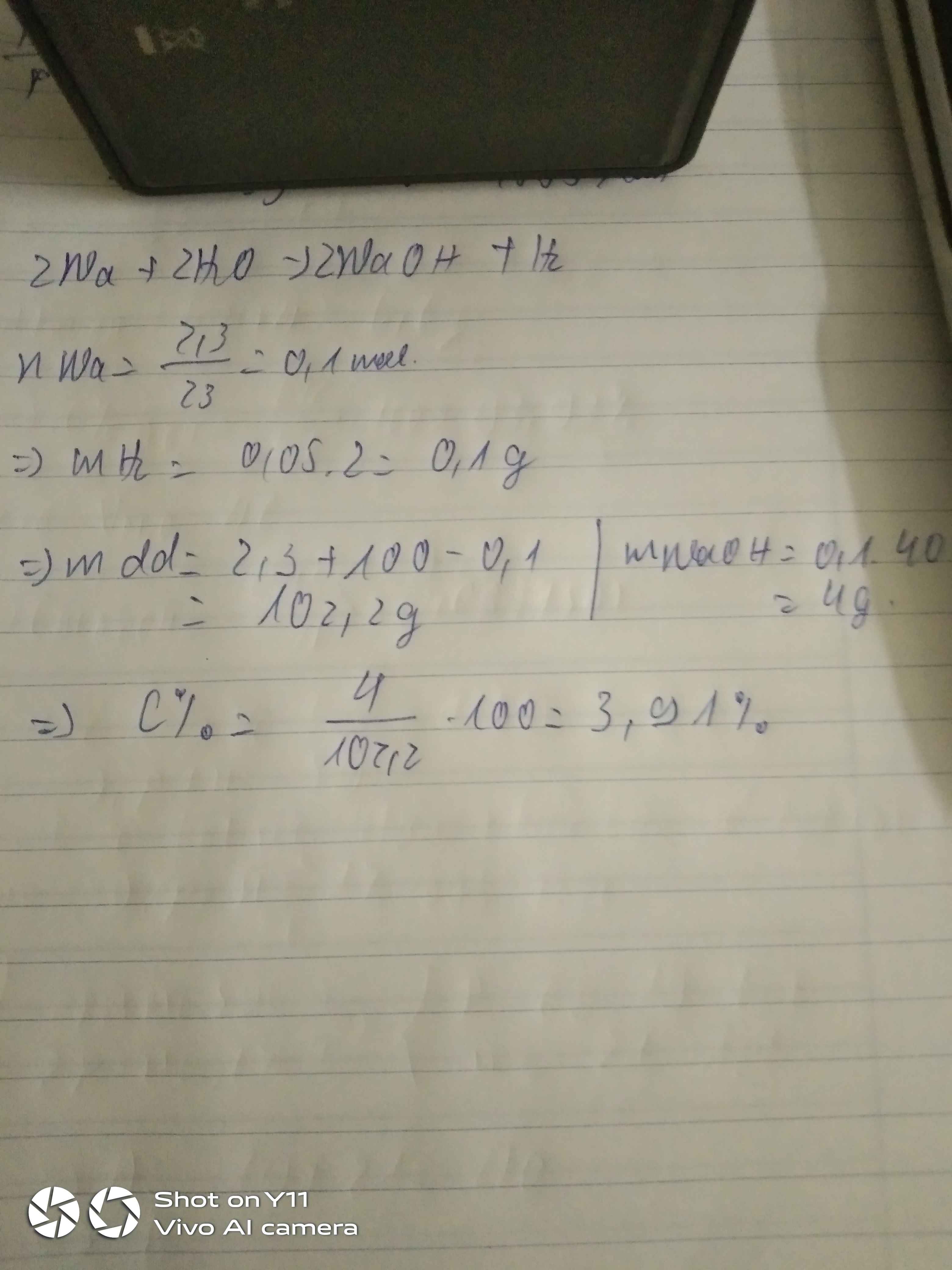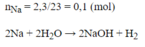cho 2,3g Na vào 50g H2O để cho pư kết thúc. Tính nồng độ % dung dịch thu được.

Những câu hỏi liên quan
cho 2,3g Na vào 100g nước tính nồng độ phần trăm dung dịch thu được
\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
Pt : \(2Na+2H_2O\rightarrow2NaOH+H_2|\)
2 2 2 1
0,2 0,2
\(n_{NaOH}=\dfrac{0,2.2}{2}=0,2\left(mol\right)\)
⇒ \(m_{NaOH}=0,2.40=8\left(g\right)\)
\(m_{ddspu}=2,3+100=102,3\left(g\right)\)
\(C_{ddNaOH}=\dfrac{8.100}{102,3}=7,82\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (1)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(n_{H_2}=\dfrac{1}{2}n_{Na}=\dfrac{1}{2}.\dfrac{2,3}{23}=0,05\left(mol\right)\)
\(\Rightarrow m_{H_2}=0,05.2=0,1\left(g\right)\)
\(\Rightarrow m_{\text{dd sau pư}}=100+2,3-0,1=102,2\left(g\right)\)
\(n_{NaOH}=n_{Na}=0,1\left(mol\right)\)
\(\Rightarrow C\%=\dfrac{0,1.40}{102,2}.100\%=3,91\%\)
Đúng 0
Bình luận (0)
Bài 2: Cho hỗn hợp 2 kim loại Na và Fe vào một lượng H2O (lấy dư), sau khi kết thúc phản ứng thu được 160 gam dung dịch A và một lượng khí phản ứng vừa đủ với 40 (g) bột Đồng (II) oxit (CuO) ở nhiệt độ cao. Tính Nồng độ phần trăm của dung dịch A
1) 2Na+2H2O → 2NaOH+H2
2) H2+CuOto→ Cu+H2O
Có nCuO=\(\dfrac{40}{80}\)=0,5 mol
Dựa vào PTHH 2) nH2=nCuO=0,5mol
Dựa vào PTHH 1) nNaOH=2nH2=0,5.2=1moll
Vậy mNaOH=1.40=40
→C%NaOH=\(\dfrac{40}{160}\).100%=25%
Đúng 2
Bình luận (0)
Bài 2:
Cho hỗn hợp 2 KL Na và Fe vào H2O dư thì chỉ có Na pư
2Na + 2H2O → 2NaOH + H2
1 <----- 0,5
H2 + CuO ---> Cu + H2O
0,5 <-- 0,5
mNaOH = 1 × 40 = 40 g
=> C% NaOH = mct/ mdd ×100
= 40/160×100 = 25%
Đúng 1
Bình luận (0)
Cho a(g) kim loại Zn vào 200ml dung dịch CuCl2 2M, sau khi pư kết thúc thu được dung dịch muối kẽm clorua và kim loại đồnga) Viết PTHH của pưb) Tính a
c) Lấy toàn bộ lượng kim loại đồng sinh ra ở pư trên cho vào 100g dd H2SO4 đặc , nóng có nồng độ 98% .Tính nồng độ phần trăm các chất có trong dung dịch sau khi pư kết thúc
a) PTHH: \(Zn+CuCl_2\rightarrow ZnCl_2+Cu\)
b) Ta có: \(n_{CuCl_2}=0,2\cdot2=0,4\left(mol\right)=n_{Zn}\) \(\Rightarrow m_{Zn}=0,4\cdot65=26\left(g\right)\)
c) PTHH: \(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu}=n_{Zn}=0,4mol\\n_{H_2SO_4}=\dfrac{100\cdot98\%}{98}=1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,4}{1}< \dfrac{1}{2}\) \(\Rightarrow\) H2SO4 còn dư, Cu phản ứng hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4\left(dư\right)}=0,2mol\\n_{CuSO_4}=n_{SO_2}=n_{Cu}=0,4mol\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{H_2SO_4\left(dư\right)}=0,2\cdot98=19,6\left(g\right)\\m_{CuSO_4}=0,4\cdot160=64\left(g\right)\\m_{SO_2}=0,4\cdot64=25,6\left(g\right)\\m_{Cu}=0,4\cdot64=25,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_{Cu}+m_{ddH_2SO_4}-m_{SO_2}=100\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{64}{100}\cdot100\%=64\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{19,6}{100}\cdot100\%=19,6\%\end{matrix}\right.\)
Đúng 1
Bình luận (2)
Cho 2,3g Na tan hết trong 47,8ml nước thu được dung dịch NaOH và có khí H2 thoát ra. Tính nồng độ % của dung dịch NaOH?
\(n_{Na}=\dfrac{2.3}{23}=0,1\left(mol\right)\)
PTHH : 2Na + 2H2O -> 2NaOH + H2
0,1 0,1 0,1 0,05
\(m_{NaOH}=0,1.40=4\left(g\right)\)
\(m_{H_2O}=47,8\left(g\right)\)
\(m_{H_2}=0,05.2=0,1\left(g\right)\)
\(m_{dd}=47,8+2,3-0,1=50\left(g\right)\)
\(C\%_{NaOH}=\dfrac{4}{50}.100\%=8\%\)
Đúng 4
Bình luận (2)
\(47,8ml=47,8g\)
\(n_{Na}=\dfrac{2,3}{23}=0,1mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,1 0,1 0,05 ( mol )
\(m_{NaOH}=0,1.40=4g\)
\(m_{dd}=2,3+47,8-0,05.2=50g\)
\(C\%_{NaOH}=\dfrac{4}{50}.100=14\%\)
Đúng 5
Bình luận (2)
Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng
Cho dung dịch CuCl vào cốc chứa 200ml dung dịch Na(OH) sau khi phản ứng kết thúc người ta thu được 9,8g 1 kết tủa màu xanh . Tính nồng độ dung dịch NaOH đã dùng biết phản ứng sảy ra hoàn toàn.
VNaOH = 200ml = 0,2 (l)
CuCl2 + 2NaOH ---> Cu(OH)2 + 2NaCl
Kết tủa là Cu(OH)2
=> mCu(OH)2 = 9,8 / 98 = 0,1 (mol)
=> nNaOH = 0,2 (mol)
=> CM NaOH = n/V = 0,2 / 0,2 = 1M
Đúng 1
Bình luận (0)
Cho 2,3g Na tan hết trong 47,8ml nước thu được dung dịch NaOH và có khí H2 thoát ra. Tính nồng độ C% của dung dịch NaOH?
mH2O = 47,8 . 1 = 47,8 (g)
nH2O = 47,8/18
nNa = 2,3/23 = 0,1 (mol)
PTHH: 2Na + 2H2O -> 2NaOH + H2
0,1 ---> 0,1 ---> 0,1 ---> 0,05
mNaOH = 0,1 . 40 = 4 (g)
mH2 = 0,05 . 2 = 0,1 (g)
mdd (sau p/ư) = 47,8 + 2,3 - 0,1 = 50 (g)
C%NaOH = 4/50 = 8%
Đúng 2
Bình luận (0)
ĐỀ hỏi nồng độ mol hay nồng độ chất tan vậy, nếu hỏi nồng độ chất tan thì đề lỗi
Đúng 1
Bình luận (0)
cho 2,3g Na tác dụng với 197,8g nước. tính thể tích khí hidro sinh ra ở đktc tính nồng độ phần trăm của dung dịch sau phản ứng tính nồng độ mol/lít của dung dịch thu được. cho khối rượn riêng của dung dịch D=1,08g/mol
\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,1-------------->0,1---->0,05
=> VH2 = 0,05.22,4 = 1,12 (l)
mdd sau pư = 2,3 + 197,8 - 0,05.2 = 200 (g)
=> \(C\%=\dfrac{0,1.40}{200}.100\%=2\%\)
\(V_{dd}=\dfrac{200}{1,08}=\dfrac{5000}{27}\left(ml\right)=\dfrac{5}{27}\left(l\right)\)
=> \(C_M=\dfrac{0,1}{\dfrac{5}{27}}=0,54M\)
Đúng 1
Bình luận (0)
Hoà tan hết 2,3g Na kim loại vào 97,8g nước thu được dung dịch có nồng độ:
A. 2,4%
B. 4,0%
C. 23,0%
D. 5,8%

C % N a O H = m N a O H m dd .100 % = 0,1.40 100 .100 % = 4 % .
Đáp án B
Đúng 0
Bình luận (0)