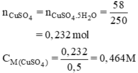Xác định nồng độ mol của dung dịch thu được khi hoà tan 12,5g cuso4.5h2o vào 87,5ml nước

Những câu hỏi liên quan
a) Xác định nồng độ mol khi hòa tan 12,5g CuSO4.5H2O vào 87,5ml nước.
b) Suy ra nồng độ % của dung dịch thu được.
c) Cho dung dịch NaOH 0,5M vào dung dịch thu được.
- Tìm khối lượng kết tủa. - Suy ra thể tích dung dịch NaOH cần dùng.
a)
\(n_{CuSO4}.5H_2O=\frac{12,5}{250}=0,05\left(mol\right)\)
\(\Rightarrow n_{CuSO4}=0,05\left(mol\right)\)
\(n_{H2O}=0,05.5=0,25\left(mol\right)\)
\(\Rightarrow V_{H2O}=87,5+0,25.18=92\left(ml\right)\)
\(CM_{CuSO4}=\frac{0,05}{0,092}=0,543M\)
b)
\(m_{dd}=87,5+12,5=100\left(g\right)\)
\(C\%=\frac{0,05.160}{100}.100\%=8\%\)
c) \(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
\(n_{Cu\left(OH\right)2}=n_{CuSO4}=0,05\left(mol\right)\)
\(m_{Cu\left(OH\right)2}=0,05.98=4,9\left(g\right)\)
\(n_{NaOH}=0,05.2=0,1\left(mol\right)\)
\(\Rightarrow CM_{NaOH}=\frac{0,1}{0,5}=0,2M\)
Hòa tan 58g muối CuSO4.5H2O vào nước được 500ml dung dịch A. Xác định nồng độ mol của dung dịch A.
Hòa tan 12,5g tinh thể CuSo4.5H2O vào 87,5ml H2O tạo dung dịch A Cho dung dịch A 40g dung dịch NaOH 15% thu được kết tủa dung dịch B a) tìm c% dung dịch A b) tìm c% dung dịch B
\(a,C\%_A=\dfrac{12,5}{12,5+87,5}.100\%=12,5\%\)
\(b,PTHH:\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
trc p/u : 0,05 0,15
p/u : 0,05 0,1 0,05 0,05
sau: 0 0,05 0,05 0,05 (mol)
-> sau p/ư NaOH dư .
\(n_{NaOH}=\dfrac{40.15\%}{40}=0,15\left(mol\right)\)
\(n_{CuSO_4}=\dfrac{12,5}{250}=0,05\left(mol\right)\)
\(m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
\(m_{ddB}=100+40=140\left(g\right)\)
\(C\%_B=\dfrac{4,9}{140}.100\%=3,5\%\)
Đúng 2
Bình luận (0)
Hoà tan 0,5 mol CuSO4.5H2O vào 245g nước. Tính nồng độ %, nồng độ mol và suy ra khối lượng riêng của dung dịch (giả sử hoà tan không làm thay đổi thẻ tích dung dịch, Dnc = 1g/ml)
Tính nồng độ % và nồng độ mol/l của dd thu được sau khi hòa tan 12,5g CuSO4.5H2O vào 87,5 ml nước. biết Vdd=V nước
đề sai chăng: Vdd sao lại có thể = V nước được
\(n_{CuSO_4.5H_2O}=\dfrac{12,5}{250}=0,05mol\)
=> mCuSO4= 0,05.160=8 gam và nCuSo4=ntt=0,05 mol
C%= 8/100=0,08 %
CM=0,05/0,1=0,5M
Đúng 0
Bình luận (2)
Hòa tan 58g muối CuSO4.5H2O vào nước được 500ml dung dịch A.
a) Xác định nồng độ mol của dung dịch A.
b) Cho dần dần bột sắt vào 50ml dung dịch A, khuẩy nhẹ cho tới khi dung dịch hết màu xanh. Tính lượng sắt đã tham gia phản ứng.
\(a.n_{CuSO_4}=n_{CuSO_4.5H_2O}=\dfrac{58}{250}=0,232\left(mol\right)\\ \Rightarrow CM_{CuSO_4}=\dfrac{0,232}{0,5}=0,464M\\ b.Fe+CuSO_4\rightarrow FeSO_4+Cu\\ 50mlddAcó0,0232molCuSO_4\\ n_{Fe}=n_{CuSO_4}=0,0232\left(mol\right)\\ \Rightarrow m_{Fe}=0,0232.56=1,2992\left(g\right)\)
Đúng 2
Bình luận (0)
Hòa tan 12.5 gam CuSO4.5H2O vào 87.5 ml nước . Tính nồng độ mol, nồng độ % của dung dịch thu được
mH2O = 87,5 . 1 = 87,5 (g)
mdd = 12,5 + 87,5 = 100 (g)
C%CuSO4.5H2O = 12,5/100 = 12,5%
Đúng 0
Bình luận (0)
\(mCuSO_4.5H_2O=nCuSO_4=\dfrac{12,5}{250}=0,05\left(mol\right)\)
\(C_{MddCuSO_4}=\dfrac{0,05}{0,0875}=0,57M\)
Đúng 0
Bình luận (0)
bài 2 :hoà tan 10g đường vào 100g nước được dung dịch nước đường . Tính nồng độ phần trăm của dung dịch nước đường thu được
bài3: hoà tan 4g NaOH vào nước được 200ml dung dịch . Tính nồng đọ mol của dung dịch thu được
Bài 2
\(C_{\%đường}=\dfrac{10}{10+100}\cdot100\%\approx9,09\%\)
Bài 3
\(n_{NaOH}=\dfrac{4}{40}=0,1mol\\ C_{M_{NaOH}}=\dfrac{0,1}{0,2}=0,5M\)
Đúng 1
Bình luận (0)
Hoà tan 0,1 mol Na2CO3 vào trong nước để được 500mlNa2CO3 a.Tính nồng độ mol của dung dịch b.Tính nồng độ phần trăm chả dung dịnh thu được , biết khối lượng riêng của Na2CO3 là 1g/m Hoà tan 0,1 mol Na2CO3 vào trong nước để được 500mlNa2CO3 a.Tính nồng độ mol của dung dịch b.Tính nồng độ phần trăm chả dung dịnh thu được , biết khối lượng riêng của Na2CO3 là 1g/m
\(a.500ml=0,5l\\ C_{M_{Na_2CO_3}}=\dfrac{0,1}{0,5}=0,2M\\ b.m_{ddNa_2CO_3}=500.1=500g\\ m_{Na_2CO_3}=0,1.106=10,6g\\ C_{\%Na_2CO_3}=\dfrac{10,6}{500}\cdot100\%=2,12\%\)
Đúng 1
Bình luận (0)