cho x gam một muối halogenua của một kim loại kiềm tác dụng với 200ml dd H2SO4 đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn thu được thu được hỗn hợp sản phẩm A trong đó có 1 khí B (mùi trứng thối). Cho khí B tác dụng với dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại làm khô thu được 342,4 gam chất rắn T. nung T đến khối lượng không đổi thu được 139,2 gam muối duy nhất.
a. tính nồng độ mol/ lít của dd H2SO4 ban đầu.
b. Xác đinh công thức phân tử của muối halogenua.
c. tính x.

Những câu hỏi liên quan
1. Cho x gam một muối halogenua của một kim loại kiềm tác dụng với 200ml dd H2SO4 đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp sản phẩm A trong đó có một khí B (mùi trứng thối). Cho khí B tác dụng với dd Pb(NO3)2 (dư) thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại, làm khô thu được 342,4 gam chất rắn T. Nung T đến khối lượng không đổi thu được 139,2 gam muối duy nhất.a. Tính nồng độ mol/lit của dd H2SO4 ban đầu.b. Xác định công thức phân tử của muối halogenua v...
Đọc tiếp
1. Cho x gam một muối halogenua của một kim loại kiềm tác dụng với 200ml dd H2SO4 đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp sản phẩm A trong đó có một khí B (mùi trứng thối). Cho khí B tác dụng với dd Pb(NO3)2 (dư) thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại, làm khô thu được 342,4 gam chất rắn T. Nung T đến khối lượng không đổi thu được 139,2 gam muối duy nhất.
a. Tính nồng độ mol/lit của dd H2SO4 ban đầu.
b. Xác định công thức phân tử của muối halogenua và tính x.
2. Cho M là kim loại tạo ra hai muối MClx, MCly và tạo ra 2 oxit MO0,5x, M2Oy có thành phần về khối lượng của Clo trong 2 muối có tỉ lệ 1 : 1,173 và của oxi trong 2 oxit có tỉ lệ 1 : 1,352.
a. Xác định tên kim loại M và công thức hóa học các muối, các oxit của kim loại M.
b. Viết các phương trình phản ứng khi cho M tác dụng lần lượt với MCly; H2SO4 đặc, nóng.
1)
a) Khí B mùi trứng thối => H2S
$Pb(NO_3)_2 + H_2S \to PbS + 2HNO_3$
n H2S = n PbS = 47,8/239 = 0,2(mol)
Gọi CTHH của muối halogen là RX
8RX + 5H2SO4 đặc,nóng → 4R2SO4 + H2S + 4X2 + 4H2O
n H2SO4 = 5n H2S = 0,2.5 = 1(mol)
CM H2SO4 = 1/0,2 = 5M
T gồm R2SO4,X2
Khi nung thì chỉ còn lại R2SO4
=> m X2 = 342,4 - 139,2 = 203,2(gam)
n X2 = 4n H2S = 0,8(mol)
=> M X2 = 2X = 203,2/0,8 = 254
=> X = 127(Iot)
Theo PTHH :
n R2SO4 = n X2 = 0,8(mol)
=> M R2SO4 = 2R + 96 = 139,2/0,8 = 174
=> R = 39(Kali)
Vậy Muối cần tìm là $KI$
n KI = 2n R2SO4 = 1,6(mol)
=> x = 1,6.166 = 265,6 gam
Đúng 3
Bình luận (0)
cho x gam một muối halogenua của một kim loại kiềm tác dụng với 200ml dd H2SO4 đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn thu được thu được hỗn hợp sản phẩm A trong đó có 1 khí B (mùi trứng thối). Cho khí B tác dụng với dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại làm khô thu được 342,4 gam chất rắn T. nung T đến khối lượng không đổi thu được 139,2 gam muối duy nhất.
a. tính nồng độ mol/ lít của dd H2SO4 ban đầu.
b. Xác đinh công thức phân tử của muối h...
Đọc tiếp
cho x gam một muối halogenua của một kim loại kiềm tác dụng với 200ml dd H2SO4 đặc, nóng vừa đủ. Sau khi phản ứng xảy ra hoàn toàn thu được thu được hỗn hợp sản phẩm A trong đó có 1 khí B (mùi trứng thối). Cho khí B tác dụng với dung dịch Pb(NO3)2 dư thu được 47,8 gam kết tủa màu đen. Phần sản phẩm còn lại làm khô thu được 342,4 gam chất rắn T. nung T đến khối lượng không đổi thu được 139,2 gam muối duy nhất.
a. tính nồng độ mol/ lít của dd H2SO4 ban đầu.
b. Xác đinh công thức phân tử của muối halogenua.
c. tính x.
Cho 7,35 gam hỗn hợp hồn 2 kim loại kẽm,sắt tác dụng với khí Clo vừa đủ để phản ứng xảy ra hoàn toàn,sau phản ứng thu được 17,645 gam hỗn hợp muối X
a)Xác định % các chất có trong hỗn hợp X?
b)Cho hỗn hợp muối X tác dụng hoàn toàn với lượng dư dung dịch AgNO3.Thu được a gam kết tủa.Xác định giá trị của a?
Xem chi tiết
Để tác dụng vừa đủ với m gam hỗn hợp X gồm Cr và kim loại M có hóa trị không đổi cần vừa đúng 2,24 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2 có tỷ khối đối với H2 là 27,7 thu được 11,91 gam hỗn hợp Z gồm các oxit và muối clorua. Mặt khác, cho m gam hỗn hợp X tác dụng với một lượng dư dung dịch HNO3 đặc, nguội thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Các phản ứng xảy ra hoàn toàn. Kim loại M là: A. Ca B. Cu C. Mg D. Zn
Đọc tiếp
Để tác dụng vừa đủ với m gam hỗn hợp X gồm Cr và kim loại M có hóa trị không đổi cần vừa đúng 2,24 lít hỗn hợp khí Y (đktc) gồm O2 và Cl2 có tỷ khối đối với H2 là 27,7 thu được 11,91 gam hỗn hợp Z gồm các oxit và muối clorua. Mặt khác, cho m gam hỗn hợp X tác dụng với một lượng dư dung dịch HNO3 đặc, nguội thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Các phản ứng xảy ra hoàn toàn. Kim loại M là:
A. Ca
B. Cu
C. Mg
D. Zn
Đáp án D
Có

m g X + HNO3 đặc nguội → 0,1 mol NO2
→ BTe a . n M = 0 , 1 m o l ( 2 )
Từ (1) và (2) suy ra:
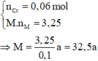
=> a = 2, M = 65 (M là Zn).
Đúng 0
Bình luận (0)
Cho 12 gam hỗn hợp X gồm 2 kim loại Fe và Cu tác dụng với H2SO4 ( đặc nóng) vừa đủ thu được 5,6 lit khí không màu, mùi hắc (đktc, sản phẩm khử duy nhất).
a. Tính khối lượng của Fe có trong hỗn hợp ban đầu.
b. Nếu cho một nửa hỗn hợp X trên tác dụng với H2SO4 loãng thì khí thu được là khí gì? Tính thể tích khí thu được ở đktc
a)
Gọi số mol Fe, Cu là a, b (mol)
=> 56a + 64b = 12 (1)
\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
a------------------------------->1,5a
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
b---------------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> mFe = 0,1.56 = 5,6 (g)
b)
1 nửa hỗn hợp X trên chứa \(\left\{{}\begin{matrix}Fe:0,05\left(mol\right)\\Cu:0,05\left(mol\right)\end{matrix}\right.\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,05---------------------->0,05
=> Thu được khí H2
VH2 = 0,05.22,4 = 1,12 (l)
Đúng 2
Bình luận (2)
Cho 17,2 gam hỗn hợp kim loại gồm Fe cà Cu tác dụng vừa đủ với dd H2SO4 đặc nóng dư thu được 6,72 lít khí SO2 (đktc) là sản phẩm khử duy nhất. Tính khối lượng mỗi muối và khối lượng dung dịch H2SO4 80% phản ứng
`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Đúng 4
Bình luận (0)
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)
Đúng 2
Bình luận (0)
Nung nóng một thời gian hỗn hợp A gồm Al và một oxit sắt (Giả sử chỉ xảy ra phản ứng khử oxit thành kim loại) được m gam hỗn hợp B. Chia hỗn hợp B thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hoàn toàn với dd KOH dư thu được 10,08 lít khí đktc và có 29,52 gam chất rắn không tan. Hòa tan hoàn toàn phần thứ 2 bằng dd H2SO4 đặc nóng, dư được 19,152 lít khí SO2 (sản phẩm khử duy nhất, đktc) và dung dịch C. Cho dd C tác dụng hoàn toàn với dd NH3 dư, lấy toàn bộ lượng kết tủa tạo thành đem nun...
Đọc tiếp
Nung nóng một thời gian hỗn hợp A gồm Al và một oxit sắt (Giả sử chỉ xảy ra phản ứng khử oxit thành kim loại) được m gam hỗn hợp B. Chia hỗn hợp B thành hai phần bằng nhau. Cho phần thứ nhất tác dụng hoàn toàn với dd KOH dư thu được 10,08 lít khí đktc và có 29,52 gam chất rắn không tan. Hòa tan hoàn toàn phần thứ 2 bằng dd H2SO4 đặc nóng, dư được 19,152 lít khí SO2 (sản phẩm khử duy nhất, đktc) và dung dịch C. Cho dd C tác dụng hoàn toàn với dd NH3 dư, lấy toàn bộ lượng kết tủa tạo thành đem nung đến khối lượng không đổi thu được 65,07 gam chất rắn. Xác định công thức của oxit sắt và tính giá trị của m.
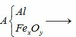
Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)
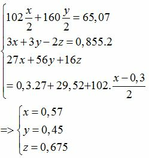
=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb
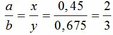
=> Fe2O3
Đúng 0
Bình luận (0)
cho m gam hỗn hợp Al và Mg tác dụng với dung dịch H2SO4 đặc nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được dug dịch A chứa 40,2 gam hốn hợp 2 muối sunfat và 7,84 lít khí SO2(đktc, sản phẩm khử duy nhất).Tính m
Cho 11,2 g sắt tác dụng với 9,6g lưu huỳnh. Phản ứng xảy ra hoàn toàn thu được hỗn hợp A. Hòa tan hỗn hợp A bằng m gam dd H2SO4 đặc, nóng thì thu được V lít khí B và dung dịch C.
1. Tính m và V
2. Cho dung dịch C tác dụng vừa đủ dung dịch Ba(OH)2 . Lọc kết tủa, nung khối lượng đến không đổi được chất rắn D. Tính khối lượng D?
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
PTHH: \(Fe+S-^{t^o}\rightarrow FeS\)
Theo đề: 0,2...0,3
Lập tỉ lệ \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\)=> Fe hết. S dư
=> Sau phản ứng hỗn hợp gồm S dư, FeS
=> \(n_{S\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
S + H2SO4 → SO2 + H2O
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2 + 10H2O
\(\Rightarrow m_{H_2SO_4}=\left(0,1+\dfrac{0,2.10}{2}\right).98=107,8\left(g\right)\)
\(V_{SO_2}=\left(0,1+\dfrac{0,2.9}{2}\right).22,4=22,4\left(l\right)\)
\(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{FeS}=0,1\left(mol\right)\)
3Ba(OH)2 + Fe2(SO4)3 → 2Fe(OH)3↓ + 3BaSO4↓ (*)
Fe(OH)3 ---to→ Fe2O3 + H2O (**)Theo PT (*) : \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe\left(OH\right)_3}=0,05\left(mol\right)\)
Theo PT (**): \(n_{Fe_2O_3}=2n_{Fe\left(OH\right)_3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
Đúng 2
Bình luận (0)





















