Điện phân nóng cháy một muối 11,7g halogenua Nã người ta thu đc 2,24 lít khí ( đktc)
a) xác định nguyên tố X
b) tính thể tích khí HK thu được khi người ta cho X tác dụng với 4,48 lí H2 ở đktc
c) tính tỷ lệ % các khí sau phản ứng

Những câu hỏi liên quan
điện phân nóng chảy một muối 11,7g NaX người ta thu được 2,24 lít khí (đktc)
a) Xác định nguyên tố X?
b) tính thể tích khí HX thu đc khi người ta cho X tác dụng với 4,48 lít H2 ở đktc
c tính tỷ lệ % các khí sau phản ứng
\(2NaX\rightarrow2Na+X_2\)
46+2X 1
11,7 0,1
=> (46+2X)0,1=11,7
<=>4,6+0,2X=11,7
<=> 0,2X=7,1
<=> X=35,5(Cl)
b, \(Cl_2+H_2\rightarrow2HCl\)
1 1 2
0,1 0,2
0,1 0,1 0,2
0 0,1 0
\(n_{H_2dư}=0,1\left(mol\right)\)
Đúng 1
Bình luận (0)
Điện phân nóng chảy một muối 11,7 g halogenua NaX. người ta thu được 2,24 lít khí (đktc)
a. xác định nguyên tố X
b. tính thể tích khí HX thu được khi người ta cho X tác dụng với 4,48 lít khí H2 ( đktc )
c. tính tỉ lệ % các khí sau phản ứng
2NaX → 2Na + X2
a, nX2 = 0,1 mol ⇒ nNaX = 2. 0,1 = 0,2 mol.
MNaX = 11,7/0,2 = 58,5 ⇒ X = 35,5 (Cl)
b, X2 + H2 → 2HX
nH2 = 0,2 mol ⇒ nHX = 2. nX2= 0,2 mol (H2 dư)
⇒ VHX = 0,2.22,4 = 4,48 l
c, Sau phản ứng có 0,2 mol khí HCl và 0,1 mol H2 dư
%HCl= 0,2/(0,2 + 0,1)= 66,67%
⇒ %H2 = 33,33%
2NaX→2Na+X2
46+2X 1
11,7 0,1
=> (46+2X)0,1=11,7
<=>4,6+0,2X=11,7
<=> 0,2X=7,1
<=> X=35,5(Cl)
b, Cl2+H2→2HCl
1 1 2
0,1 0,2
0,1 0,1 0,2
0 0,1 0
nH2dư=0,1(mol)
Câu 13: Cho 24g CuO tác dụng với khí H2 khi đun nóng. Thể tích khí H2 (đktc) cho phản ứng trên là:A. 11,2 lít B. 13,44 lít C. 6,72 lít D. 2,24 lítCâu 14: Cho khí H2 tác dụng với Fe2O3 đun nóng thu được 5,6g Fe Khối lượng Fe2O3 đã tham gia phản ứng là:A. 12g B.13g C.15g D.16g
Đọc tiếp
Câu 13: Cho 24g CuO tác dụng với khí H2 khi đun nóng. Thể tích khí H2 (đktc) cho phản ứng trên là:
A. 11,2 lít B. 13,44 lít C. 6,72 lít D. 2,24 lít
Câu 14: Cho khí H2 tác dụng với Fe2O3 đun nóng thu được 5,6g Fe
Khối lượng Fe2O3 đã tham gia phản ứng là:
A. 12g B.13g C.15g D.16g
Cho 11,2 gam Fe tác dụng với dung dịch HCL . sau phản ứng thu được sắt ( II) clorua và khí Hidro.
Tính mFeCl2
b, Tính Vh2
C. Người ta đem đốt cháy lượng H2 đó sử dụng 4,48 lít khí oxi (đktc). Tính khối lượng H2O thu được sau phản ứng
Mọi người giải giúp em câu C với ạ
\(\begin{array} {l} a)\\ Fe+2HCl\to FeCl_2+H_2\\ n_{Fe}=\dfrac{11,2}{56}=0,2(mol)\\ n_{FeCl_2}=n_{Fe}=0,2(mol)\\ m_{FeCl_2}=0,2.127=25,4(g)\\ b)\\ n_{H_2}=n_{Fe}=0,2(mol)\\ V_{H_2}=0,2.22,4=4,48(l)\\ c)\\ n_{O_2}=\dfrac{4,48}{22,4}=0,2(mol)\\ 2H_2+O_2\xrightarrow{t^o}2H_2O\\ \dfrac{n_{H_2}}{2}<n_{O_2}\to O_2\text{ dư}\\ n_{H_2O}=n_{H_2}=0,2(mol)\\ m_{H_2O}=0,2.18=3,6(g) \end{array}\)
Đúng 1
Bình luận (0)
a: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
nên \(n_{FeCl_2}=0,2\left(mol\right)\)
\(m_{FeCl_2}=0.2\cdot127=25,4\left(g\right)\)
b: \(V_{H_2}=0.2\cdot22.4=4.48\left(lít\right)\)
Đúng 10
Bình luận (1)
a) Phân hủy hoàn toàn 63,2 gam KMnO4 sẽ thu đc bao nhiêu lít khí oxi ở đktc. Cùng lúc đó người ta cho 28 gam bột sắt tác dụng hết với dung dịch HCl, tính thể tích H2 thu đc ở đktcb) Dẫn các khí thu đc từ các thí nghiệm trên vào bình kín không có không khí rồi thực hiện phản ứng đốt cháy. Hỏi sau phản ứng cháy chất nào dư? Dư bao nhiêu gam ?c) Nếu dẫn thể tích H2 đó vào 1 bình kín chứa 166 gam Fe3O4 nung nóng. Sau phản ứng xong tính khối lượng Fe3O4 phản ứng và khối lượng sắt sinh ra.
Đọc tiếp
a) Phân hủy hoàn toàn 63,2 gam KMnO4 sẽ thu đc bao nhiêu lít khí oxi ở đktc. Cùng lúc đó người ta cho 28 gam bột sắt tác dụng hết với dung dịch HCl, tính thể tích H2 thu đc ở đktc
b) Dẫn các khí thu đc từ các thí nghiệm trên vào bình kín không có không khí rồi thực hiện phản ứng đốt cháy. Hỏi sau phản ứng cháy chất nào dư? Dư bao nhiêu gam ?
c) Nếu dẫn thể tích H2 đó vào 1 bình kín chứa 166 gam Fe3O4 nung nóng. Sau phản ứng xong tính khối lượng Fe3O4 phản ứng và khối lượng sắt sinh ra.
a) nKMnO4= 63,2/158=0,4(mol)
nFe=0,5(mol)
PTHH: KMnO4 -to-> K2MnO4 + MnO2 + 1/2 O2
0,4________________________________0,2(mol)
=>V(O2,đktc)=0,2.22,4=4,48(l)
PTHH: Fe + 2 HCl -> FeCl2 + H2
0,5_____________________0,5(mol)
=> V(H2,đktc)=0,5.22,4=11,2(l)
b) H2 + 1/2 O2 -to-> H2O
0,5/2 > 0,2/1
=> H2 dư, O2 hết, tính theo nO2
=> nH2(dư)=0,5 - 0,2.2=0,1(mol)
=>mH2(dư)=0,1.2=0,2(g)
c) nFe3O4=166/232= 83/116(mol)
PTHH: Fe3O4 + 4 H2 -to-> 3 Fe + 4 H2O
nFe3O4(p.ứ)=0,5/4=0,125(mol)
=> mFe3O4=0,125.232=29(g)
nFe=3/4. 0,5=0,375(mol)
=>mFe=0,375.56=21(g)
Đúng 1
Bình luận (0)
Cho 11,2 gam Fe tác dụng với dung dịch HCL . sau phản ứng thu được sắt ( II) clorua và khí Hidro.
Tính mFeCl2
b, Tính Vh2
C. Người ta đem đốt cháy lượng H2 đó sử dụng 4,48 lít khí oxi (đktc). Tính khối lượng H2O thu được sau phản ứng
`Fe + 2HCl -> FeCl_2 + H_2`
`0,2` `0,2` `0,2` `(mol)`
`n_[Fe]=[11,2]/56=0,2(mol)`
`a)m_[FeCl_2]=0,2.127=25,4(g)`
`b)V_[H_2]=0,2.22,4=4,48(l)`
`c)n_[O_2]=[4,48]/[22,4]=0,2(mol)`
`2H_2 + O_2` $\xrightarrow{t^o}$ `2H_2 O`
`0,2` `0,1` `0,2` `(mol)`
Ta có:`[0,2]/2 < [0,2]/1`
`=>O_2` dư
`=>m_[H_2 O]=0,2.18=3,6(g)`
Đúng 2
Bình luận (4)
Cho 11,2 gam Fe tác dụng với dung dịch HCL . sau phản ứng thu được sắt ( II) clorua và khí Hidro.
Tính mFeCl2
b, Tính Vh2
C. Người ta đem đốt cháy lượng H2 đó sử dụng 4,48 lít khí oxi (đktc). Tính khối lượng H2O thu được sau phản ứng
tham khảo
a) nFe= mFeMFe=11,256=0,2(mol)mFeMFe=11,256=0,2(mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
b) Theo PTHH và đề bài , ta có:
nH2=nFe=0,2(mol)nH2=nFe=0,2(mol)
Thể tích khí hiđro thu được (đktc):
=> VH2(đktc)=nH2.22,4=0,2.22,4=4,48(l)VH2(đktc)=nH2.22,4=0,2.22,4=4,48(l)
c) Ta có: nHCl= 2.nFe= 2.0,2=0,4(mol)
Khối lượng HCl cần dùng trong phản ứng:
mHCl=nHCl.MHCl= 0,4.36,5= 14,6(g)
d) Ta có:
nFeCl2=nFe=0,2(mol)nFeCl2=nFe=0,2(mol)
Khối lượng FeCl2 tạo thành:
mFeCl2=nFeCl2.MFeCl2=0,2.127=25,4(g)mFeCl2=nFeCl2.MFeCl2=0,2.127=25,4(g)
Đúng 2
Bình luận (1)
Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít
C
O
2
(đktc) và 2,25 g
H
2
O
. Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít
H
2
(đktc).1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.2. Tính giá trị m.
Đọc tiếp
Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít C O 2 (đktc) và 2,25 g H 2 O . Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít H 2 (đktc).
1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
2. Tính giá trị m.
1. Số mol
C
O
2
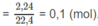
Số mol
H
2
O
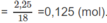
Khi đốt ancol A, số mol H 2 O tạo thành < số mol C O 2 . Vậy A phải là ancol no, mạch hở. A có dạng C n H 2 n + 2 - x ( O H ) x hay C n H 2 n + 2 O x .
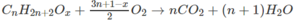
Theo đầu bài ta có:
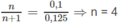
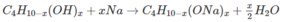
Theo phương trình : Cứ (58 + 16x) g A tạo ra 0,5000x mol H 2 .
Theo đầu bài:
Cứ 18,55 g A tạo ra 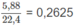 mol
H
2
.
mol
H
2
.
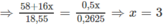
CTPT của A là C 4 H 10 O 3 .
Theo đầu bài A có mạch cacbon không nhánh; như vậy các CTCT thích hợp là
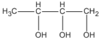 (butan-1,2,3 triol)
(butan-1,2,3 triol)
Và 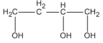 (butan-1,2,4-triol)
(butan-1,2,4-triol)
2. Để tạo ra 0,1 mol C O 2 ;
Số mol A cần đốt là: 
Như vậy: m = 0,025 x 106 = 2,65 (g).
Đúng 0
Bình luận (0)
Người ta dùng H2 (dư) tác dụng hết với x gam Fe2O3 nung nóng thu được y gam Fe. Cho lượng sắt này tác dụng với dung dịch H2SO4 loãng dư thì thu được 6,72 lít khí H2 (đktc). Tính giá trị x và y.
Đọc tiếp
Người ta dùng H2 (dư) tác dụng hết với x gam Fe2O3 nung nóng thu được y gam Fe. Cho lượng sắt này tác dụng với dung dịch H2SO4 loãng dư thì thu được 6,72 lít khí H2 (đktc). Tính giá trị x và y.
PTHH: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)=n_{Fe}\)
\(\Rightarrow n_{Fe_2O_3}=0,15\left(mol\right)\) \(\Rightarrow m_{Fe_2O_3}=x=0,15\cdot160=24\left(g\right)\)
Đúng 2
Bình luận (0)




























