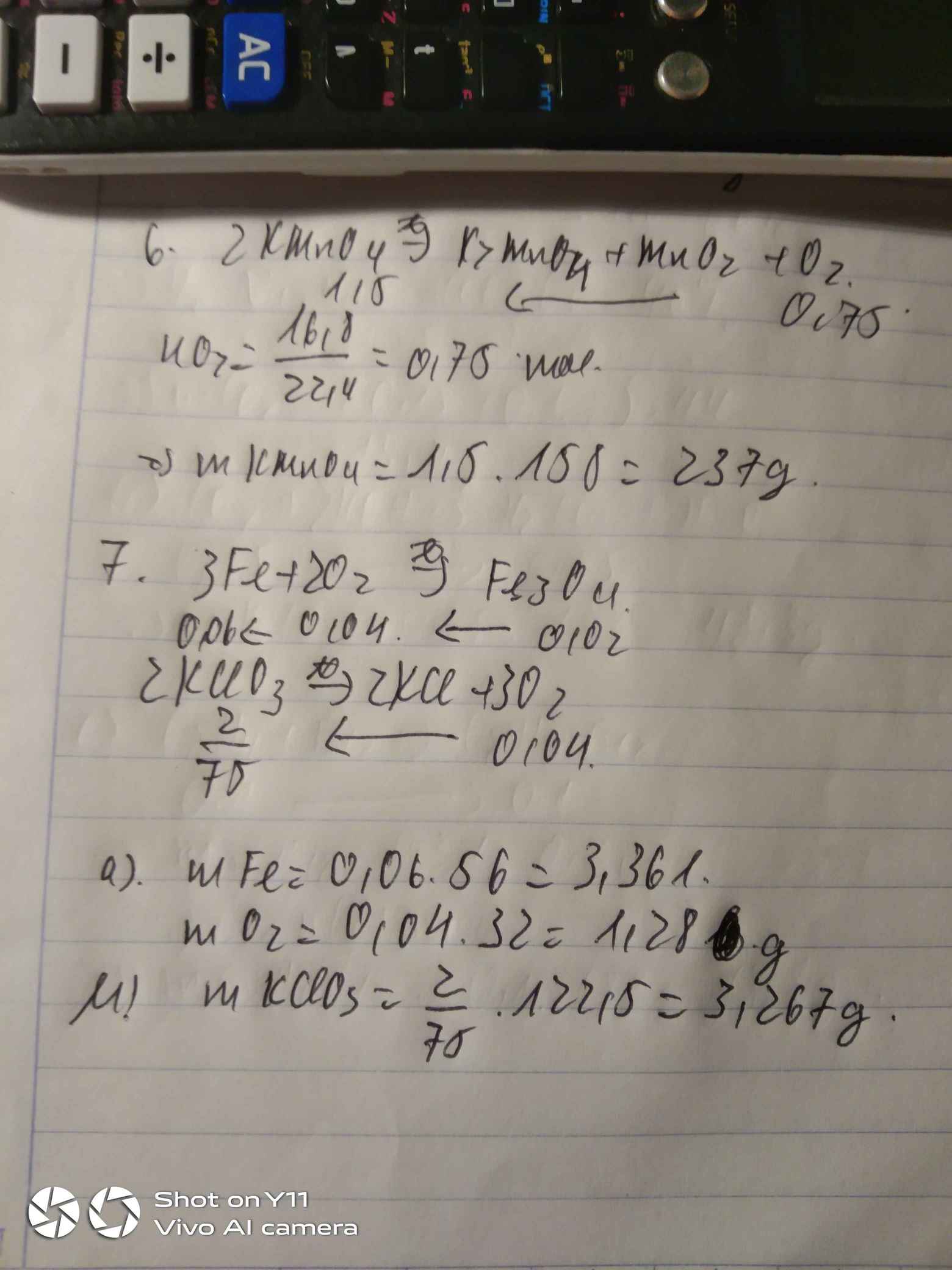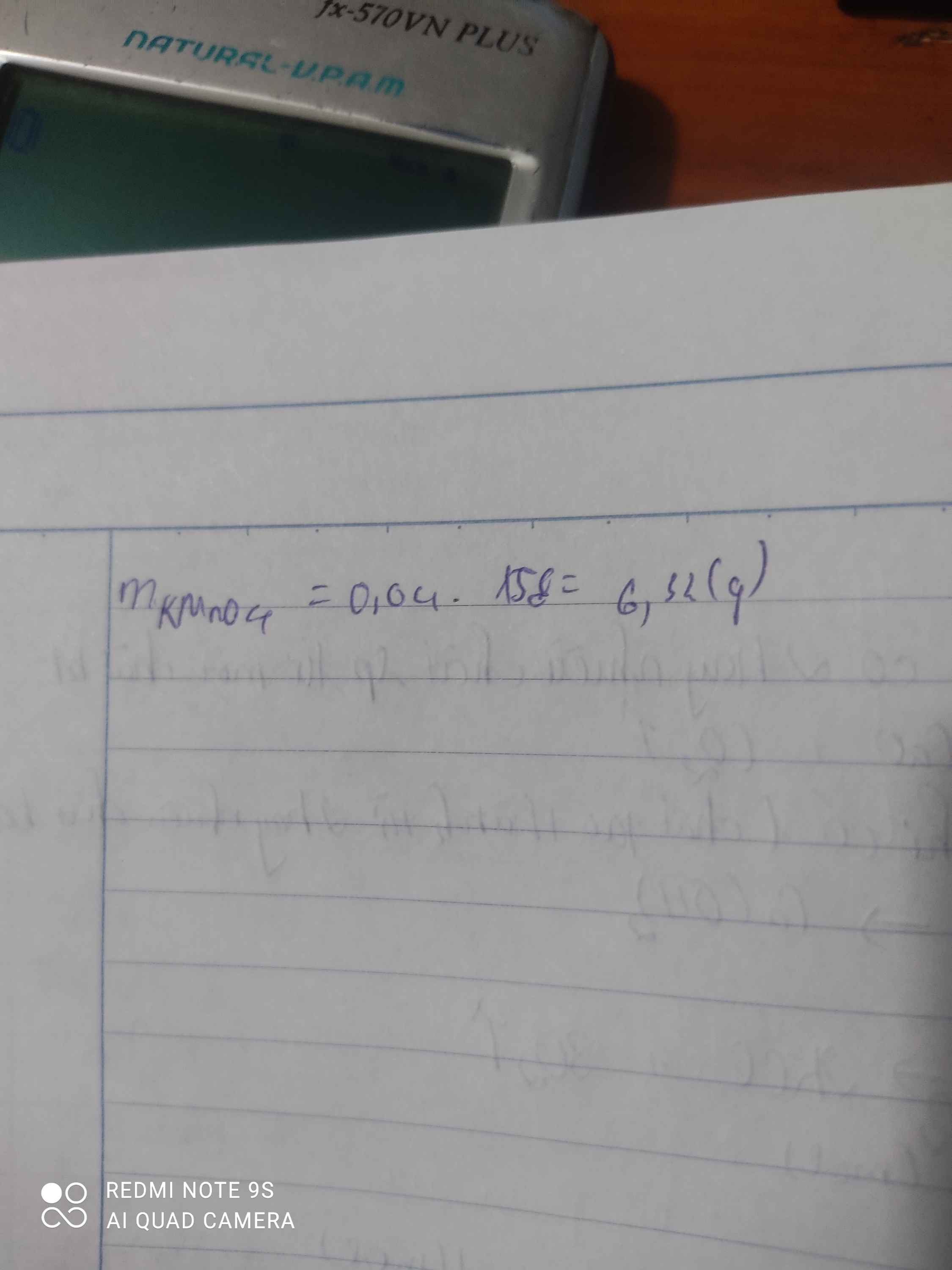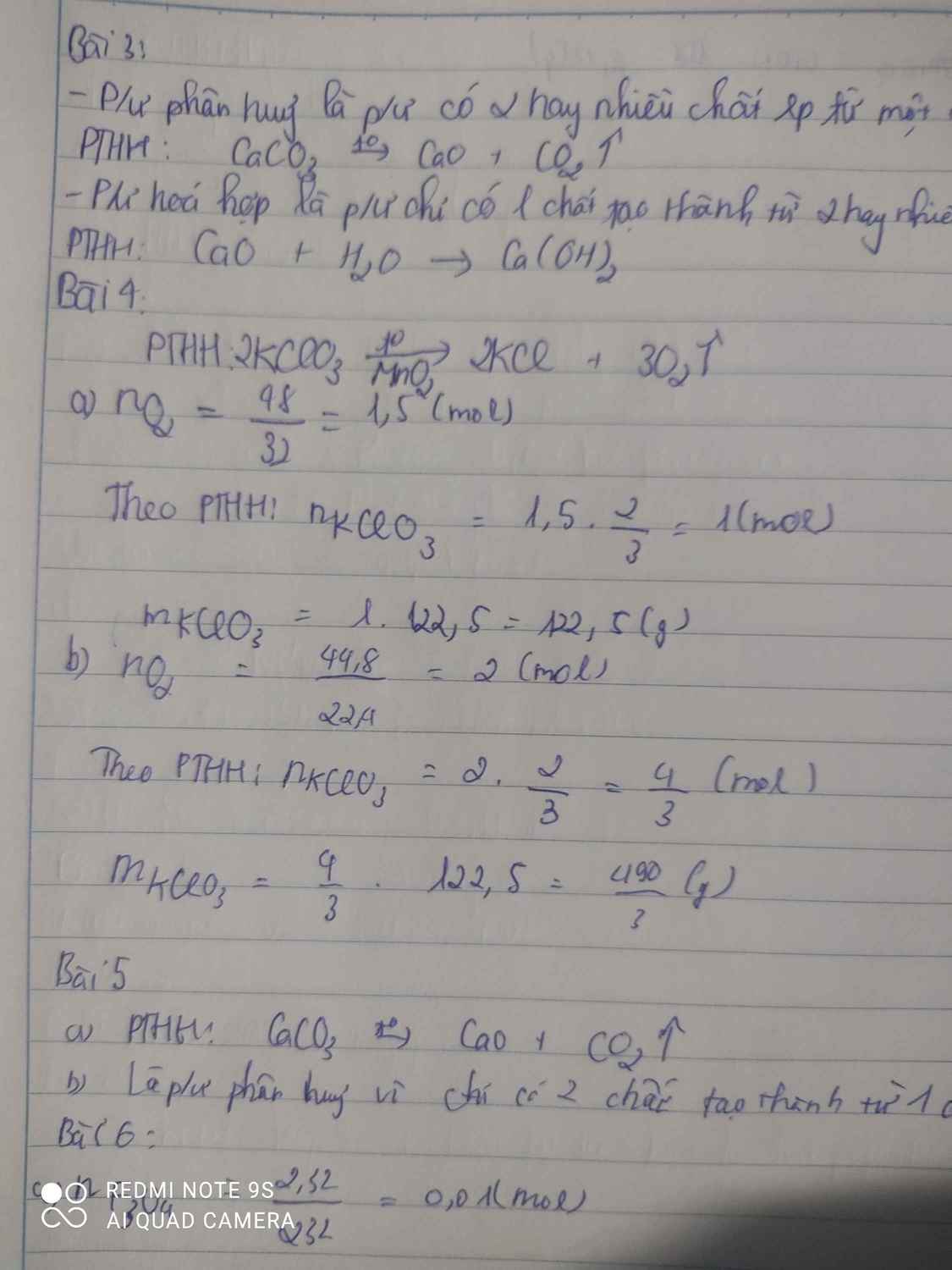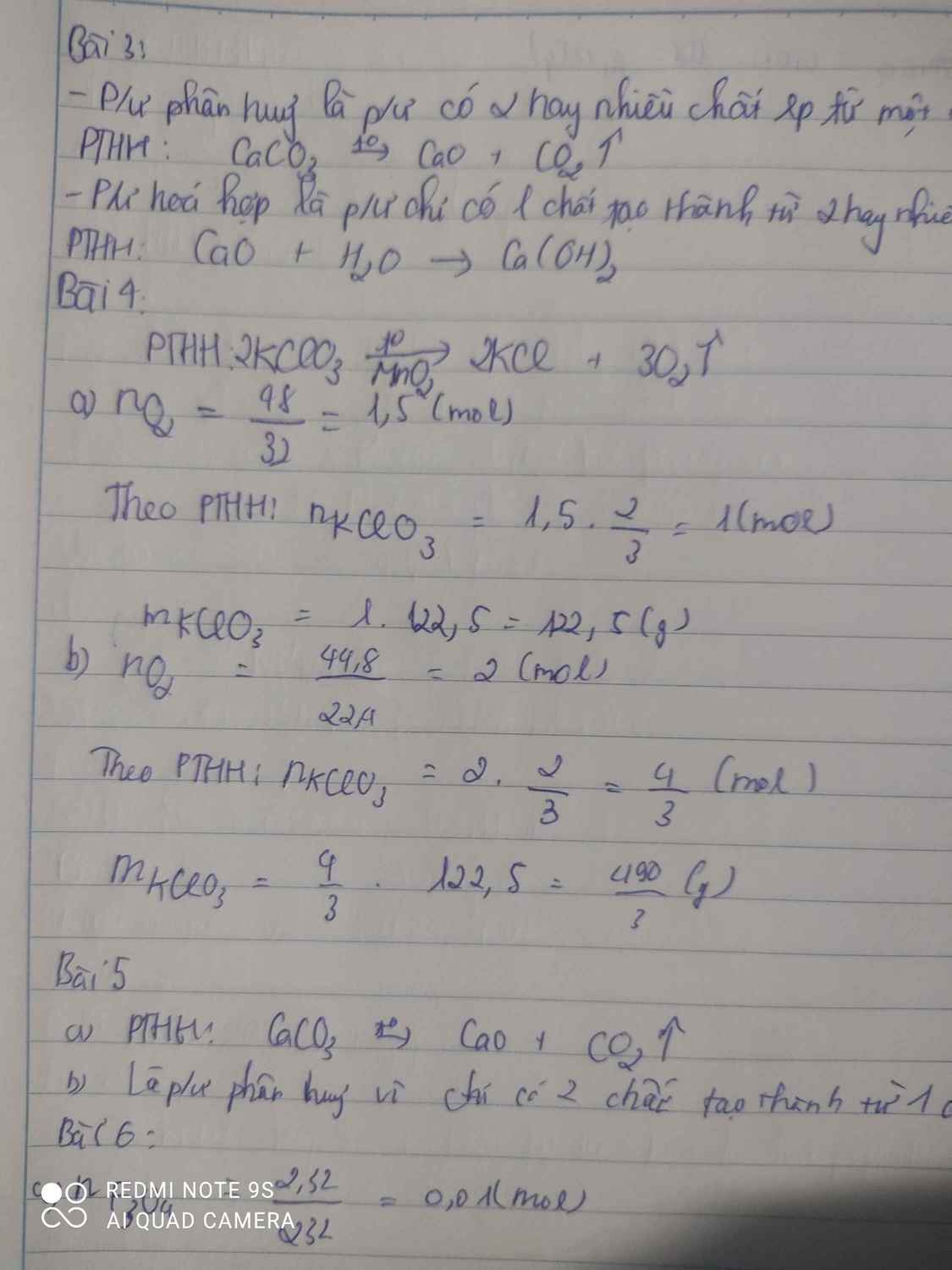Tính số gam KClO3 cần thiết để điều chế được 33,6 lít khí oxi

Những câu hỏi liên quan
Tính số gam KClO3 cần thiết để điều chế được 33,6 lít khí oxi
nO2=33,6/22,4=1,5mol
PTHH: 2KClO3=>2KCl+3O2
TheoPT:2mol 2mol 3mol
Theo bài:1mol 1,5mol
mKClO3=1.122,5=122,5g
Đúng 0
Bình luận (0)
nO2 = \(\dfrac{33,6}{22,4}\)= 1,5 ( mol )
2KClO3 → 2KCl + 3O2 (to)
Từ phương trình ta có
nKClO3 = 1 ( mol )
⇒ mKClO3 = 1.122,5 = 122,5 (g)
Đúng 0
Bình luận (0)
Tính số gam kali clorat cầm thiết để điều chế được 48 gam khí oxi. Biết trong PTN, oxi được điều chế từ KClO3 theo phản ứng: KClO3 --> KCl + O2
e cần gấp ạ
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{48}{32}=1,5mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
1 1,5 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=1.122,5=122,5g\)
Đúng 3
Bình luận (0)
\(n_{O_2}=\dfrac{48}{32}=1,5\left(mol\right)\)
PTHH : 2KClO3 -> 2KCl + 3O2
1 1,5
\(m_{KClO_3}=1.122,5=122,5\left(g\right)\)
Đúng 2
Bình luận (0)
tính số mol và số gam kali clorat cần thiết để điều chế được :
a, 48g khí oxi b, 44,8 lít khí oxi (đktc)
$2KClO_3 \xrightarrow{t^o} 2KCl +3 O_2$
a) n O2 = 48/32 = 1,5(mol)
n KClO3 = 2/3 n O2 = 1(mol)
m KClO3 = 1.122,5 = 122,5(gam)
b) n O2 = 44,8/22,4 = 2(mol)
n KClO3 = 2/3 n O2 = 4/3 (mol)
m KClO3 = 122,5.4/3 = 163,33(gam)
Đúng 3
Bình luận (0)
\(a.\)
\(n_{O_2}=\dfrac{48}{32}=1.5\left(mol\right)\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(1...............................1.5\)
\(m_{KClO_3}=1\cdot122.5=122.5\left(g\right)\)
\(b.\)
\(n_{O_2}=\dfrac{44.8}{22.4}=2\left(mol\right)\)
\(2KClO_3\underrightarrow{^{t^0}}2KCl+3O_2\)
\(\dfrac{4}{3}.................2\)
\(m_{KClO_3}=\dfrac{4}{3}\cdot122.5=163.3\left(g\right)\)
Đúng 1
Bình luận (0)
Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi.
b) 44,8 lít khí oxi (ở đktc).
a) Phương trình phản ứng:
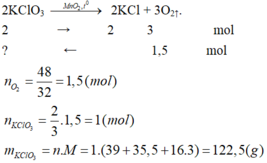
b) Phương trình phản ứng:
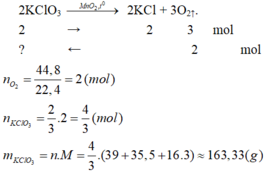
Đúng 1
Bình luận (0)
a) Tính số gam KMnO4 cần dùng để điều chế 6,72 lít khí oxi
b) tính khối lượng khí oxi thu dc khi nhiệt phân 24,5g KClO3
Xem chi tiết
\(a)\ n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,3.2 = 0,6(mol)\\ \Rightarrow m_{KMnO_4} = 0,6.158 = 94,8(gam)\\ b)\ n_{KClO_3} = \dfrac{24,5}{122,5} = 0,2(mol)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{O_2} = \dfrac{3}{2}n_{KClO_3} = 0,3(mol)\\ \Rightarrow m_{O_2} = 0,3.32 = 9,6(gam)\)
Đúng 1
Bình luận (0)
a) nO2 = \(\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Pt: \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
Theo pt: \(n_{KMnO_4}=2nO_2=0,6\left(mol\right)\Rightarrow m_{KMnO_4}=0,6.158=94,8g\)
b) \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,3\left(mol\right)\)
\(Pt:2KClO_3\rightarrow2KCl+3O_2\)
\(nO_2=\dfrac{3}{2}n_{KClO_3}=0,45\left(mol\right)\Rightarrow mO_2=0,45.32=14,4g\)
Đúng 0
Bình luận (0)
`Tính số mol và số gam Kali Clorat cần thiết để điều chế được :a) 48g khí oxib) 44,8 lít khí oxi ( đo ở đktc )
a) PTHH: 2KClO3-->2KCl + 3O2 1mol <---1mol<---1,5mol nO2=48/32=1,5mol=> nKClO3=1 =>mKClO3=1.122,5=122,5 gamvậy cần 122,5 gam KClO3 để điều chế 48 gam khí oxi
b)PTHH: 2KClO3-->2KCl + 3O2 4/3mol <---4/3mol<---2mol nO2=44,8/22,4=2mol=> nKClO3=4/3mol =>mKClO3=4/3.122,5=163,33333gamVậy cần 163,33333gam KClO3 để điều chế 44,8 lít khí oxi ở đktc
Đúng 1
Bình luận (0)
Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Đọc tiếp
Bài 6: Nung nóng Kali pemanganat KMnO4 thu được K2MnO4, MnO2 và khí O2. Hãy tính khối lượng KMnO4 cần thiết để điều chế 16,8 lít khí oxi (đktc).
Bài 7: a, Tính số gam sắt và oxi cần dung để điều chế 4,64g oxit sắt từ Fe3O4. b, Tính số gam Kali clorat KClO3 cần dùng để có lượng oxi dùng cho phản ứng trên.
Câu 6.
\(n_{O_2}=\dfrac{16,8}{22,4}=0,75mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1,5 0,75
\(m_{KMnO_4}=1,5\cdot158=237g\)
Câu 7.
\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,04 0,02
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
\(\dfrac{2}{75}\) 0,04
\(m_{KClO_3}=\dfrac{2}{75}\cdot122,5=\dfrac{49}{15}\approx3,27g\)
Đúng 3
Bình luận (1)
Bài 6 :
\(n_{O_2}=\dfrac{16.8}{22,4}=0,75\left(mol\right)\)
PTHH : 2KMnO4 ----t0-----> K2MnO4 + MnO2 + O2
1,5 0,75
\(m_{KMnO_4}=1,5.158=237\left(g\right)\)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Bài 4: Tính số mol và số gam kali clorat cần thiết để điều chế được: a) 48g khí oxi.b) 44,8 lít khí oxi (ở đktc). Bài 6: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao. a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMn...
Đọc tiếp
Bài 4: Tính số mol và số gam kali clorat cần thiết để điều chế được:
a) 48g khí oxi.
b) 44,8 lít khí oxi (ở đktc). Bài 6: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách dùng oxi hóa sắt ở nhiệt độ cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính số gam kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho phản ứng trên, biết rằng khi nung nóng 2 mol KMnO4 thì thu được 1 mol O2.
Khi đốt cháy sắt trong khí oxi thu đc oxit sắt từ Fe3O4
a)Tính số gam sắt và số gam oxi cần dùng để điều chế 4,64g Fe3O4
b)Tính số gam kalipemanganat KClO3 cần dùng để điều chế lượng khí ôxi nói trên
a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\\n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
\(m_{O_2}=0,04.32=1,28\left(g\right)\)
b, Phần này đề bài cho là KMnO4 hay KClO3 vậy bạn?
Đúng 3
Bình luận (1)
a)
nFe3O4 = 4.64/232 = 0.02 (mol)
3Fe + 2O2 -to-> Fe3O4
0.06__0.04______0.02
mFe = 0.06*56 = 3.36 (g)
Ủa kali pemanganat là KMnO4 mà ta ?
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.08_________________________0.04
mKMnO4 = 0.08*158 = 12.64 (g)
Đúng 1
Bình luận (0)