hòa tan 2,74gam một kim loại trong nước , thu được 0,448 lít h2 (đktc) .tên kim loại là
Bài 24. Hòa tan 3,6g một kim loại A hóa trị II bằng một lượng dư axit HCl thu được 3,36 lít khí H2 (đktc). Xác định tên kim loại A
Bài 25. Hòa tan hoàn toàn 8,1g kim loại A hóa trị III trong dd HCl dư thu đucợ 10,08 lít khí H2 (đktc). Xác định tên A và m HCl đã dùng
Bài 24:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:A+2HCl\rightarrow ACl_2+H_2\uparrow\)
Theo pthh: nA = nH2 = 0,15 (mol)
=> MA = \(\dfrac{3,6}{0,15}=24\left(\dfrac{g}{mol}\right)\)
=> A là Mg
Bài 25:
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\ PTHH:2A+6HCl\rightarrow2ACl_3+3H_2\uparrow\\ Mol:0,3\leftarrow0,9\leftarrow0,3\leftarrow0,45\\ \rightarrow\left\{{}\begin{matrix}M_A=\dfrac{8,1}{0,3}=27\left(\dfrac{g}{mol}\right)\Rightarrow A:Al\\m_{HCl}=0,9.36,5=32,85\left(g\right)\end{matrix}\right.\)
Bài 24.
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(n_A=\dfrac{3,6}{M_A}\) mol
\(A+2HCl\rightarrow ACl_2+H_2\)
0,15 0,15 ( mol )
\(\Rightarrow\dfrac{3,6}{M_A}=0,15mol\)
\(\Leftrightarrow M_A=24\) ( g/mol )
=> A là Magie ( Mg )
Bài 25.
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(n_A=\dfrac{8,1}{M_A}\) mol
\(2A+6HCl\rightarrow2ACl_3+3H_2\)
0,3 0,45 ( mol )
\(\Rightarrow\dfrac{8,1}{M_A}=0,3\)
\(\Leftrightarrow M_A=27\) g/mol
=> A là nhôm ( Al )
Hoà tan hoàn toàn 5,8 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 1 lít dung dịch chứa một chất tan có nồng độ 0,04M và 0,448 lít khí H2 (đktc). Kim loại M là
A. Na.
B. Ba.
C. Ca.
D. K.
Chọn B.
Hỗn hợp 5,8 gam có M (a mol) và M2Ox (b mol) Þ Ma + (2M + 16x).b = 5,8 (1)
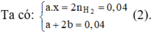
Với x = 1 hoặc 2 thay vào (1), (2) suy ra M = 137 (Ba)
Hoà tan hoàn toàn 5,8 gam hỗn hợp gồm kim loại M và oxit của nó vào nước, thu được 1 lít dung dịch chứa một chất tan có nồng độ 0,04M và 0,448 lít khí H2 (đktc). Kim loại M là
A. Na
B. Ba
C. Ca.
D. K
\(2M+2H_2O\rightarrow2MOH+H_2\)
0,4 mol \(\leftarrow\) 0,2 mol
Khối lượng mol của \(M\) là:
\(M=\dfrac{m}{n}=\dfrac{9,2}{0,4}=23\)
Vậy \(M\) là kim loại \(Na\)
Câu 5: Hòa tan 5,98 gam kim loại R ( chưa rõ hóa trị ) vào nước dư, thu được 2,912 lít H2 (đktc). Xác định tên kim loại đem dùng?
Gọi hóa trị của kim loại R là x (x > 0)
n H2 = 2,912/22,4 = 0,13 (mol)
PTPƯ: 2R + 2xH2O -> 2R(OH)x + xH2
Theo ptpư: n R = 2/x n H2 = 2/x . 0,13 = 0,26/x (mol)
M R = m R/n R = 5,98/(0,26/x) = 23x
Với x=1 -> R = 23 (Na)
Gọi n là hóa trị của R (x \(\ge\) I)
PT: 2R + 2nH2O ---> 2R(OH)n + nH2
Ta có: \(n_{H_2}=\dfrac{2,912}{22,4}=0,13\left(mol\right)\)
Theo PT: nR = \(\dfrac{2}{n}.n_{H_2}=\dfrac{2}{n}.0,13=\dfrac{0,26}{n}\)(mol)
=> MR = \(\dfrac{5,98}{\dfrac{0,26}{x}}\) = 23n (g/mol)
Biện luận:
| n | 1 | 2 | 3 |
| MR | 23 (Tm) | 46 (loại) | 69 (loại) |
Vậy R là Natri (Na)
Hòa tan hoàn toàn 3,9 gam một kim loại hóa trị I vào nước được một dung dịch bazơ X và 1,12 lít H2 (đktc). Tên kim loại hóa trị I là
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(A+H_2O\rightarrow AOH+\dfrac{1}{2}H_2\)
\(0.1................................0.05\)
\(M_A=\dfrac{3.9}{0.1}=39\left(đvc\right)\)
\(A:K\left(kali\right)\)
Hòa tan 2,74 (g) Kim loại R thuộc nhóm A vào 200ml ddHCl 0,1M thu được 0,448 lít khí H2 ( ở đktc). Xác định R?
\(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
\(n_{HCl}=0,1.0,2=0,02\left(mol\right)\)
Do 2nH2 > nHCl
=> HCl hết, R tác dụng với nước sinh ra H2
PTHH: 2R+ 2nHCl --> 2RCln + nH2
\(\dfrac{0,02}{n}\)<-0,02------------->0,01
2R + 2nH2O --> 2R(OH)n + nH2
\(\dfrac{0,02}{n}\)<----------------------0,01
=> \(n_A=\dfrac{0,02}{n}+\dfrac{0,02}{n}=\dfrac{0,04}{n}\left(mol\right)\)
=> \(M_R=\dfrac{2,74}{\dfrac{0,04}{n}}=68,5n\left(g/mol\right)\)
Xét n = 2 thỏa mãn: MR = 137 (g/mol)
=> R là Ba
Hòa tan 5,4g một kim loại hóa trị III vào dung dịch H2SO4 lượng dư. Sau p/ứ thu được 6,72 lít khí H2 (đktc). Xác định tên kim loại.
nH2 = 6.72/22.4 = 0.3 (mol)
2A + 3H2SO4 => A2(SO4)3 + 3H2
0.2______________________0.3
MA = 5.4/0.2 = 27
=> A là : Al
nH2 = 3.36/22.4 = 0.15 (mol)
M + H2SO4 => MSO4 + H2
0.15________________0.15
MM = 3.6/0.15 = 24
M là : Mg
Bảo toàn electron :
\(2n_M = 2n_{H_2}\\ \Rightarrow n_M = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ \Rightarrow M = \dfrac{3,6}{0,15} = 24(Magie)\)
Vậy Kim loại M là Magie