Cho dd CH3COOH nồng độ 0,043 M . Độ điện li = 0,02
a; dung dịch axit acitic có những phân tử điện li nào
b: tính nồng độ của các chất ion có trong phân tử
Dd HCl và dd CH3COOH có cùng nồng độ mol/1, pH của hai dd tương ứng là x và y. Quan hệ giữa x và y là (giả thiết, cứ 100 phân tử CH3COOH thì có 1 phân tử điện li)
A. y = x - 2
B. y = 2x
C. y = 100x
D. y = x + 2
Đáp án D
Lấy mỗi axit nông độ là 0,1M
HCl H+ + Cl-
0,1 0,1 => pH = -1og(0,1) = 1=> x=1
CH3COOH ⥂ CH3COO- + H+
0,1 → 0,1/100 = 0,001
=> pH = -1og(0,001) = 3 => y=3
=> Đáp án D.
Cho một dung dịch axit HA có nồng độ 1M với Ka = 10-8. Tính độ điện li của dung dịch? A. 2% B. 1% C. 0,01% D. 0,02%
Cho các dd có cùng nồng độ: NaCl, Na2SO4, H2SO3, CH3COOH. Dung dịch có khả năng dẫn điện tốt nhất là
Cho 12.6g MgCO3 vào 200g dd CH3COOH
a) Tính V ?
b) Tính nồng độ phần trăm của dd CH3COOH cần dùng
\(n_{MgCO_3}=\dfrac{12.6}{84}=0.15\left(mol\right)\)
\(Mg+2CH_3COOH\rightarrow\left(CH_3COO\right)_2Mg+CO_2+H_2O\)
\(0.15..........0.3............................................0.15\)
\(V_{CO_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(m_{CH_3COOH}=0.3\cdot60=18\left(g\right)\)
\(C\%_{CH_3COOH}=\dfrac{18}{200}\cdot100\%=9\%\)
Pthh MgCO3+2CH3COOH--->(CH3COO)2Mg+CO2+H2O
Ta có nMgCO3=0,15 mol
Theo pthh thì nCH3COOH=0,3 mol
=>mCH3COOH=17,7 g
=>C%CH3COOH=8,85%
cho 200ml dd ch3cooh tác dụng vừa đủ với 100ml dd NaOH 0,5M a. tính nồng độ mol của dd Ch3cooh đã phản ứng và khối lượng muối tạo thành
Ta có: \(n_{NaOH}=0,1.0,5=0,05\left(mol\right)\)
PT: \(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
Theo PT: \(n_{CH_3COOH}=n_{CH_3COONa}=n_{NaOH}=0,05\left(mol\right)\)
a, \(C_{M_{CH_3COOH}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
b, \(m_{CH_3COONa}=0,05.82=4,1\left(g\right)\)
Cho 2 dung dịch HCl và CH3COOH có cùng nồng độ. Dung dịch HCl có pH = x, dung dịch CH3COOH có pH = y. Bỏ qua sự điện li của nước, các dung dịch ở cùng nhiệt độ phòng. Biết ở nhiệt độ phòng, cứ 100 phân tử CH3COOH thì có 1 phân tử phân li ra ion. Mối liên hệ của x và y là:
A. x = y - 2
B. y = x – 2
C. x = 2y
D. y = 2x
Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
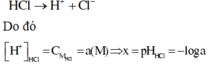
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
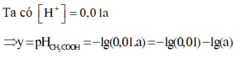
![]()
Đáp án A.
Trong 1 ml dd HNO2 ở nhiệt độ nhất định có 5,64.10\(^{19}\)phân tử HNO2 ; 3,6.10\(^{18}\)ion NO2\(^-\)
a) Tính nồng độ điện li của HNO2 trong dd ở nhiệt độ trên
b) Tính nồng độ mol của dd nói trên
\(n_{HNO_2}=\dfrac{5,64.10^{19}}{6.10^{23}}=9,4.10^{-5}\)
\(n_{NO_2^-}=\dfrac{3,6.10^{18}}{6.10^{23}}=6.10^{-6}\)
\(HNO_2⇌H^++NO_2^-\)
Ta có :
\(n_{HNO_2}=9,4.10^{-5}+6.10^{-6}=10^{-4}\)
Độ điện li \(\alpha=\dfrac{6.10^{-6}}{10^{-4}}=0,06\)
b)
\(C_{M_{HNO_2}}=\dfrac{10^{-4}}{10^{-3}}=0,1M\)
Trong dung dịch CH3COOH 4,3. 10 - 2 M, người ta xác định được nồng độ H + bằng 8 , 6 . 10 - 4 mol/l. Hỏi có bao nhiêu phần trăm phân tử C H 3 C O O H trong dung dịch này điện li ra ion ?
Trung hoà 100ml dd CH3COOH có nồng độ a (M) bằng 200g dd NaOH 10% có D= 1,11 g/ml. Hãy tính (a) a (b) Thể tích dung dịch NaOH đã dùng (c) khối lượng muối thu được (d) nồng độ mol dd muối thu được sau pứ