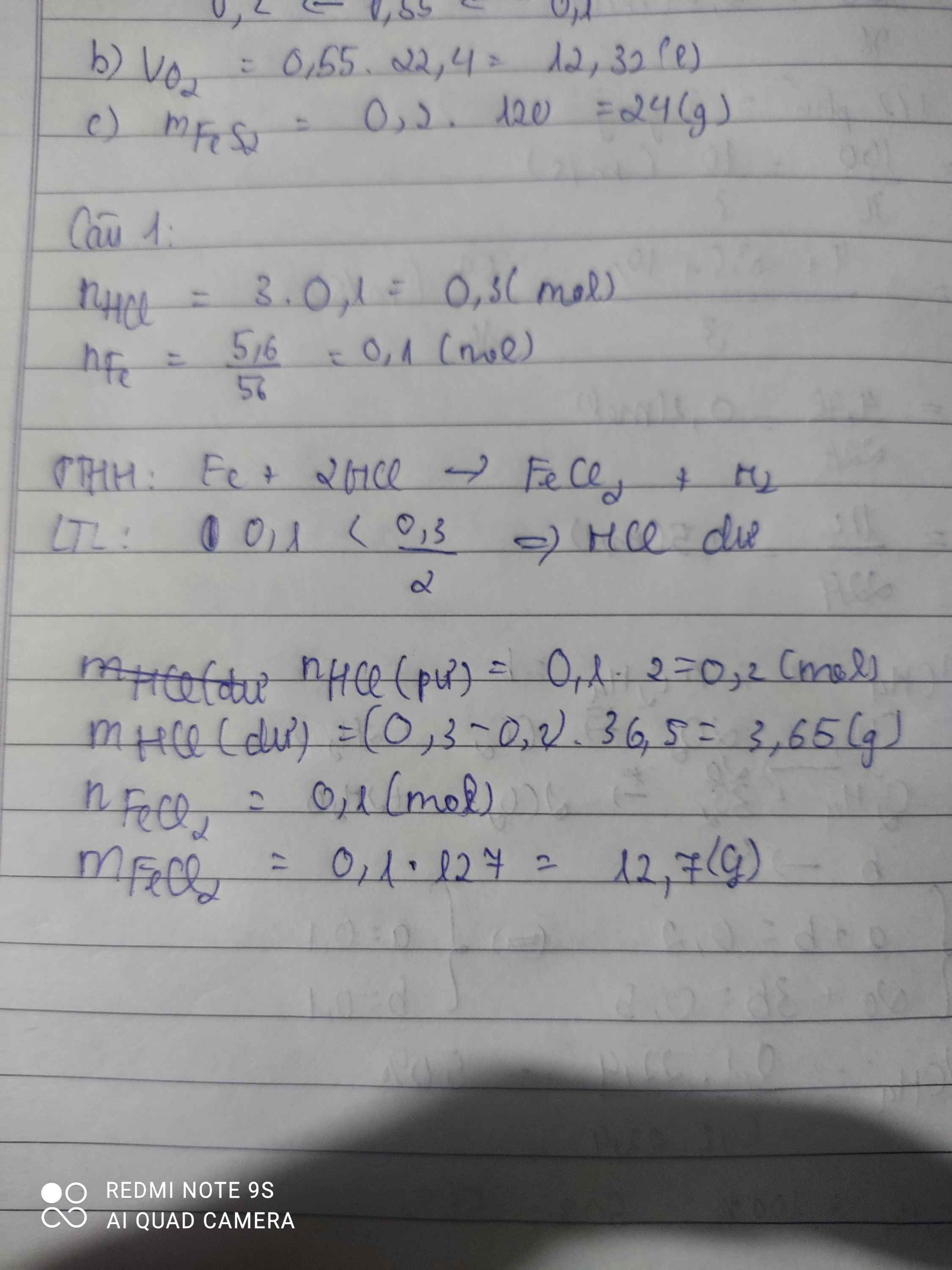Cho 5,6 gam Fe phản ứng với 100 ml dd HCl 3M. Tính khối lượng chất dư sau phản ứng

Những câu hỏi liên quan
Cho 5,6 gam Fe phản ứng với 100 ml dd HCl 3M. Tính khối lượng chất dư sau phản ứng
nHCl=0,1.3=0,3(mol)
nFe=5,6/56=0,1(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
Ta có: 0,3/2 > 0,1/1
=> Fe hết, HCl dư => Tính theo nFe
=> nHCl(dư)= 0,3 - 2.0,1=0,1(mol)
=>mHCl(dư)=36,5.0,1=3,65(g)
Đúng 3
Bình luận (0)
\(n_{Fe}=0,1\left(mol\right)\)
\(n_{HCl}=3.0,1=0,3\left(mol\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\Rightarrow\) HCl dư.
\(\Rightarrow n_{HCl\text{ pư}}=2n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\text{ dư}}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{HCl\text{ dư}}=0,1.36,5=3,65\left(g\right)\)
Đúng 0
Bình luận (0)
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
100ml = 0,1l
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=3.0,1=0,3\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,1 0,3
Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ Fe phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của Fe
Số mol dư của dung dịch axit clohidric
ndư = nban đầu - nmol
= 0,3 - (0,1. 2)
= 0,1 (mol)
Khối lượng dư của dung dịch axit clohidric
mdư = ndư . MHCl
= 0,1 . 36,5
= 3,65 (g)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
GIÚP EM BÀI NÀY VS Ạ GẮP LẮM R
Câu 1: Cho 100 ml dung dịch HCl 3M vào bình phản ứng chứa 5,6 gam Fe, phản ứng kết thúc thu được dung dịch A. Xác định khối lượng các chất có trong dd A. (Cho MH = 1,
MCl = 35,5, MFe = 56)
2HCl+Fe->FeCl2+H2
0,1----0,1 mol
n HCl=0,3 mol
n Fe=0,1 mol
=>HCl dư . dư 0,1 mol
=>m FeCl2=0,1.127=12,7g
=>m HCl dư=0,1.36,5=3,65g
Đúng 2
Bình luận (0)
Cho 5,6 g Fe vào 200 ml dung dịch HCl 1,5M
a, viết ptpư
b, chất nào dư sau phản ứng, tính khối lượng chất dư
c, tính nồng độ mol của các chất sau phản ứng ( biết thể tích thay đổi không đáng kể)
Xem chi tiết
nFe = 0,1 mol
nHCl = 0,3 mol
Fe + 2HCl ---> FeCl2 + H2
0,1 < 0,3/2 .....=> HCl dư sau phản ứng
nFeCl2 = 0,1 mol => CM = 0,1/0,2 = 0,5M
nHCl(dư) = 0,1 mol => CM = 0,1/0,2 = 0,5M
Đúng 1
Bình luận (2)
a) PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
b) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\n_{HCl}=0,2\cdot1,5=0,3\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\) \(\Rightarrow\) Fe p/ứ hết, HCl còn dư
\(\Rightarrow n_{HCl\left(dư\right)}=0,1\left(mol\right)\) \(\Rightarrow m_{HCl\left(dư\right)}=0,1\cdot36,5=3,65\left(g\right)\)
c) Theo PTHH: \(n_{FeCl_2}=n_{Fe}=0,1\left(mol\right)=n_{HCl\left(dư\right)}\)
\(\Rightarrow C_{M_{FeCl_2}}=C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Đúng 1
Bình luận (0)
Hoà tan hoàn toàn 5,6 gam Fe vào 200 ml dung dịch HCl 2M .
a) Tìm chất dư, khối lượng chất dư ?
b) Tính thể tích khí H2 tạo ra ở đktc ?
c) Tính nồng độ mol của dung dịch sau phản ứng ?
nFe = 5.6/56 = 0.1 (mol)
nHCl = 0.2*2 = 0.4 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
LTL : 0.1/1 < 0.4/2 => HCl dư
mHCl dư = ( 0.4 - 0.2 ) * 36.5 = 7.3 (g)
VH2 = 0.2*22.4 = 4.48 (l)
CM FeCl2 = 0.1/0.2 = 0.5(M)
CM HCl dư = 0.2 / 0.2 = 1(M)
Đúng 4
Bình luận (1)
Cho 5,6 gam Fe tác dụng với dd axit clohidric 15% , sau phản ứng thu được dd sắt (II) clorua và khí hidro a viết phương trình phản ứng b. tính thể tích hidro thoát ra (ở đktc) c. tính khối lượng dung dịch hcl tham gia phản ứng
Fe + 2HCl -> FeCl2 + H2
nFe = 5,6/56 = 0,1 mol
=>nH2 = 0,1 mol
=> VH2= 0,1*22,4= 2,24 lít
Đúng 1
Bình luận (0)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,1-->0,2------------------>0,1
=> \(\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{0,2.36,5}{15\%}=\dfrac{146}{3}\left(g\right)\\V_{H_2}=0,1.22,4=4,48\left(l\right)\end{matrix}\right.\)
Đúng 0
Bình luận (2)
Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl 2M lấy dư, sau phản ứng thuđược 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Tính % theo khối lượng từng chất trong hỗn hợp banđầu và thể tích HCl tham gia phản ứng
mCu = 2 (g)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 10,3 - 2 = 8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,1.27}{10,3}.100\%=26,21\%\\\%Fe=\dfrac{0,1.56}{10,3}.100\%=54,37\%\\\%Cu=\dfrac{2}{10,3}.100\%=19,42\%\end{matrix}\right.\)
\(n_{HCl}=2.n_{H_2}=0,5\left(mol\right)\)
=> \(V_{dd.HCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)
Đúng 2
Bình luận (0)
Hoà tan kim loại fe vào dd hcl 20% . Phản ứng vừa đủ , thu đc 14,874 lít hydrogen (dktc) 25°C , 1 bar.tính khối lượng kim loại fe phản ứng? A.tính khối lượng dd hcl 20% phản ứng? B.tính nồng độ % dd sau phản ứng? C.tính số ml dd ca(oh)2 3M để trung hòa lượng acid hcl ở trên?
Cho 5,6 g sắt vào 100 ml dung dịch HCl 1M.Hãy: a. Tính lượng khí H₂ tạo ra ở đktc? b. Chất nào còn dư sau phản ứng và lượng dư là bao nhiêu? c. Tính nồng độ các chất sau phản ứng ?
\(a,n_{HCl}=0,1.1=0,1\left(mol\right)\\ n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
LTL: \(0,1>\dfrac{0,1}{2}\) => Fe dư
Theo pthh: \(n_{H_2}=n_{FeCl_2}=n_{Fe\left(pư\right)}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
=> VH2 = 0,05.22,4 = 1,12 (l)
b, Chất dư là Fe
mFe (dư) = (0,1 - 0,05).56 = 2,8 (g)
c, \(C_{M\left(FeCl_2\right)}=\dfrac{0,05}{0,1}=0,5M\)
Đúng 2
Bình luận (0)
hòa tan hoàn toàn 5,6 g sắt vào 100 ml dd HCl 1 M
a tính lượng khí H2 tạo ra ở đktc
b chất nào còn dư sau phản ứng và dư bao nhiêu
Fe+2HCl->fecl2+H2
0,05---0,1-----------0,05
n Fe=0,1 mol
n HCl=0,1 mol
=>VH2=0,05.22,4=1,12l
b)
=>Fe dư
m Fedu=0,05.56=2,8g
Đúng 3
Bình luận (0)